各种各样的药品挤满了货架,但制药公司仍绞尽脑汁开发新药。开发新药绝非易事,但一种全新研发策略让研究者看到新希望,那就是运用生物分子别构作用(allosterism)对症下药。一些人甚至预测,这将带来一场药物研发革命,促进治疗当前治疗手段难以应对的疾病。
传统的新药研发策略,是用药物分子模仿人类机体中激素和神经递质(neurotransmitter)等信号分子的作用。药物分子能够深入机体与细胞表面的受体结合,精确程度不亚于人类机体自身释放的分子与受体结合。如果药物分子嵌入到合适的受体激活位点,像钥匙打开匹配的门锁,受体就会接到指令,触发一连串生化反应在细胞中进行。但是药物分子一旦结合到不适宜的受体,就会抑制正常生化信号的传递。当前市场上流行的大多数药物——抗过敏药、β-受体阻滞剂(beta blocker)、抗精神病药等,都是根据这种原理开发的。
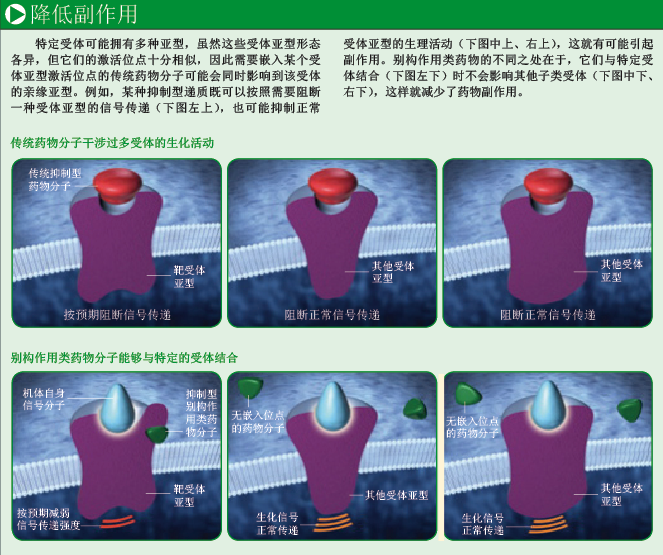
但这些药物要么可以治疗疾病,要么完全不起作用。药物分子可以激活或阻断生理通路,却不能起到适度调节的作用。通过进化,人类机体能够利用相同化学物质服务多种生理目的,即一种内源分子通常可以和一系列的受体亚型(receptor subtype,参见环球科学小词典)进行结合,每种受体亚型又控制不同的生理过程。原本用来执行特定神经递质任务的药物最终可能影响到很多受体亚型的活动,从而引发药物的副作用。传统研发策略的这种缺陷,使科学家很难寻找到针对某些疾病的安全治疗手段。
在技术研发过程中,研究人员的一些偶然发现让制药公司逐渐脱离模仿生物分子作用机理的传统思路。新的研发策略试图使药物作用的受体区域不再是机体递质的激活位点。此类药物称为别构作用类药物(顾名思义,“别构”就是“结合在其他位点,形成别的结构”),能够在细胞受体区域的特殊部分发挥作用,只影响在这些区域活动的受体,以降低药物的副作用。拿电灯开关来打比方,这些药物不再仅仅控制电灯的亮或灭,还可以对亮度进行调节——药物能够根据实际需要,对机体中信号传递通路的激活程度进行强弱调节。
瑞士Addex生物技术公司正在进行部分药物的临床测试,也是首家专营此类药物的公司。其他公司也纷纷开始在别构作用类药物上大做文章,目前,美国辉瑞(Pfizer)与安进(Amgen)两家制药公司研发的别构作用类药物,已经获得美国食品及药品管理局(FDA)的许可,用于治疗艾滋病和慢性肾功能衰竭。
在混乱中寻找秩序
别构作用并非全新概念。早在20世纪初,研究酶类 (催化生化过程的蛋白质)的作用时,科学家就已经对此非常熟悉了。当时科学家发现,一些小分子往往能够结合在一个酶分子的不同位置上,并相应改变这个酶分子的结构和功能。但直到20世纪90年代,科学家才尝试将别构作用的思路移植到药物研发领域。
长期以来,许多制药公司专注于研究一种名为G蛋白偶联受体(G-protein coupled receptor,GPCR)的细胞表面蛋白分子群。这群蛋白分子像蛇一样,能够通过细胞膜反复穿行于细胞内外7次,启动细胞内物质对细胞外部环境作出反应。当GPCR分子位于细胞外部表面,配体(ligand,能够与受体结合的生物分子)嵌入到GPCR分子上的激活位点,促使受体结构改变,并激活另外一种名为G蛋白的分子,这种分子随即启动细胞内部的生化信号传递。人体里有800多种GPCR分子,约100种可能出现在任何一个细胞表面。目前市售的药物能够有效结合的GPCR分子仅占全部种类的1/8。“针对GPCR分子的研究,我们只揭开了冰山一角,”澳大利亚莫纳什大学药理学家阿瑟·赫里斯托普洛斯(Arthur Christopoulos)说。
20世纪80年代至90年代初,药理学家用放射配体检测法(radioligand assay)开发新一代GPCR药物。他们首先确认试图影响的特定受体(该受体或许与某种疾病的致病机理有关),并将一个经过放射性标记的配体嵌入该受体。然后,嵌入了配体的受体与测试药物将一起参与血液循环,药理学家依次测定哪些药物可以在机体血液循环中取代配体的位置。被取代的配体越多,该药物的效果就越好。
上述方法可用来研发能够结合激活位点的药物,这种激活位点在商业中被称为“正位作用位点”(orthosteric site)。在当时,这是药物研发的首选方案,药理学家并没有发现、也没有兴趣去研究别构作用类药物是否可以取得类似效果。不幸的是,经过一段时间的测试,正位法并没有给人们带来品种足够多的可用药物,失败的原因也不甚明晰。
到了20世纪90年代中期,制药公司将更多生理学原理融入新方法。他们采用功能性测定法(functional assay)来进行观察,关注的焦点由药物使特定受体结合区域发生的变化,转向了它们对那些含有目标受体的细胞整体代谢活动的影响。赫里斯托普洛斯对此感慨道:“从此整个过程变得有趣了。”在功能性测试的观察中,生物分子时而增强受体功能,时而抑制受体功能。正位作用类药物亦同此理。一些研究者揭示出别构作用是导致疗效不稳定的始作俑者,只是其中大部分人没有认识到别构作用也是有用的。
1999年,美国加利福尼亚州拉霍亚的一家生物技术公司——SIBIA神经科学公司与诺华制药合作,发现了一种可用于降低促进代谢型谷氨酸5受体(mGlu5)活性的生物分子。这是首批发现的选择性别构作用调质(modulator,参见环球科学小词典)之一,而mGlu5是30多种谷氨酸神经递质受体亚型之一。SIBIA公司一直致力于研发针对mGlu5的调质,该受体与多种神经性官能障碍密切相关,其中包括癫痫。
据美国范德堡大学药理学家P·杰弗里·康恩(P. Jeffrey Conn)回忆,这是制药商首次研发出别构作用类分子。尽管如此,由于测试过程中频繁出现不确定的结果,大多数公司对于别构作用类药物仍持谨慎的观望态度。“我不知道天方夜谭这个词是否有些夸张,”康恩回忆说,但别构作用“并没有获得大多数人的认同”。
尽管SIBIA公司的mGlu5拮抗剂(antagonist,能够与受体结合,具有较强亲和力而无内在活性的药物)未能作为药物投入生产,这项发现还是引发了科学家的思考。其中之一就是文森特·米泰尔(Vincent Mutel),当时他还是罗氏(Roche)公司的药理学家,现在已经是Addex公司的首席执行官。2001的时候,他和同事偶然发现了能够增强促进代谢型谷氨酸1受体(mGlu1)活性的别构作用分子。这项发现虽然不能应用于疾病治疗,但是它使米泰尔认识到别构作用分子不仅可以作为受体拮抗剂,还可以作为受体促进剂。他推测,通过实验还可以找到调控其他谷氨酸受体活性的别构作用分子。其中一些受体的活动与精神分裂和焦虑障碍有关。
2001年底,米泰尔离开了罗氏公司,与来自葛兰素史克(GlaxoSmithKline)、罗氏以及普华永道(PricewaterhouseCoopers)的同事创立了Addex公司,追逐共同的理想。米泰尔回忆说:“我们大家全力以赴,自问‘能否转变GPCR的研究思路?为何不在别构作用分子上施展拳脚?’”
小改变带来大回报
由于别构作用类药物性质特殊,在疾病治疗方面与传统的正位分子相比更具优势。别构分子与细胞结合后,会略微改变受体结构,使机体内的配体更易于嵌入到激活位点。也就是说,只有机体中存在配体时,别构作用分子才能够发挥作用。“如果仅把别构分子放置在激活位点,它不会产生任何效果,”米泰尔解释道。某种疾病是由于机体内正常产生的化学物质不能有效地与受体结合而产生。那么,当且仅当该化学物质存在时,帮助它有效结合受体的药物便是治疗的最佳选择。只有别构作用类药物能够做到这一点,正位作用药物一旦进入机体就会立刻激活受体反应,破坏机体的正常代谢过程。
别构作用类药物仅在配体存在时起调节作用。这使它们比一些正位作用药物更加安全。在镇静剂安定(Valium)发现之初,没人了解它的工作机理;现在科学家已经认识到,它是通过别构作用来增强γ-氨基丁酸(GABA)受体活性的,而GABA正是人类机体中主要的抑制型神经递质。其他中枢神经系统抑制剂,例如苯巴比妥(phenobarbitol),一旦大量摄入便有致死的危险,但是安定不然。赫里斯托普洛斯解释说:“只有当大脑释放出GABA,且GABA与受体结合后,附着在受体表面的安定药物分子才会发挥作用,使GABA与受体结合的效力提升5~10倍。”他还说,摄入过量安定的人通常通过睡眠就可以消除影响。

别构作用分子的另一个特性在于,它们并不嵌入受体激活位点,这就意味着它们可以与受体某一亚型进行特定的结合。美国默克制药公司(Merck & Co)高级副总裁达里尔·舍普(Darryle Schoepp)解释说,同一种正位配体可以与许多受体结合。某种神经递质可能和十多个受体亚型结合,而这些亚型受体控制各种各样的生化信号传递。自然选择不需要机体进化到每个受体都各不相同的程度。能够嵌入mGlu2非正位结合位点的别构作用分子可以避开mGlu3或其他受体亚型——别构作用分子避免了与其他受体不必要的交互作用,因此减少了药物副作用。
别构作用类药物以多种方式改变受体结构,因而它们可以调节受体活性的强弱。正如前面那个比喻,控制别构作用类药物可以起到调节强度的功效,而不再是传统药物那样要么完全激活受体要么毫无作用。这种特性可以控制受体活性在十分微弱到极端强烈之间变化。葛兰素史克的一位研究负责人特里·凯纳金(Terry Kenakin)提到,许多疾病是很细微的生化过程紊乱或信号传递障碍的结果,别构作用类药物有助于扭转这些过程,使机体恢复正常。
从理论构思到临床应用
拥有如此众多的优点,难怪药学家现在都热衷于研究别构作用。正如康恩所说:“这一领域的发展日新月异。”Addex公司目前已在实验室中开发出60,000余种别构作用调质,从中筛选可以对GPCR分子及其他受体和离子通道发挥作用的调质。目前该公司正在对编号为ADX10059的化合物进行人体临床试验,这种药物通过减弱mGlu5与谷氨酸的结合强度来治疗由胃食管反流病(gastrointestinal reflux disorder,GERD)引起的偏头痛和胃灼热(heartburn)。另外一种由Addex公司研发的mGlu5拮抗剂,用于治疗由帕金森病引起的非自主震颤,已经通过了临床安全测试。同时,Addex、默克与强生三家公司正在通力合作,研发针对精神分裂症和焦虑的别构作用调质。
当前已有两种别构作用类药物上市出售,一种是安进公司2004年获准生产的西那卡塞(cinacalcet),该药物在美国市场中的商品名称为Sensipar,通过激活钙离子受体治疗慢性肾功能衰竭。另外一种是辉瑞公司2007年获准生产的抗艾新药马拉韦罗(maraviroc),其商品名为Selzentry。马拉韦罗作用于CCR5受体,该受体可以结合免疫化学物质趋化因子(chemokine,参见环球科学小词典),也会协助HIV病毒进入细胞。Selzentry改变了CCR5的结构,使它变成阻拦HIV病毒进入细胞。凯纳金提到该药物的不足之处时不无遗憾,因为它也阻断了抗艾物质趋化因子与CCR5的结合。他希望将来出现既可以阻拦HIV病毒又不会削弱趋化因子的药物。
别构作用剂确实还面临许多挑战。研究伊始,测试实验结果扑朔迷离、难以重复成了困扰科学家的难题,至今仍是研究工作的瓶颈所在。以GPCR为例,按照赫里斯托普洛斯的说法,GPCR“存在于所有细胞之中,它们与G蛋白相结合,而G蛋白的种类也多得数不胜数”。一个GPCR可以与多种配体结合,并调控不同的生化通路,具体发挥何种作用取决于该受体所处的组织环境。因此,科学家必须在不同组织系统中对别构作用类药物进行多样化测试分析,以确保这些化合物在正确的地方发挥正确的作用。
最后,米泰尔指出:“是药三分毒。”但总体而言,别构作用类药物比正位作用药物更加安全,因为它们需要的摄入量更小,并且仅在机体自身配体存在时发挥作用。尽管如此,它们的作用还是无法与机体自身释放的配体相提并论。此外,并非所有别构作用药物都是安全的,其中一些药物分子作用于无关受体仍会引发副作用。
尽管困难重重,药物科学家仍旧信心十足,他们认为别构作用将为药物研发带来深远影响。默克公司的舍普坦承:“药物研发过程效率低下、进展缓慢,使我们承受了许多负面压力。”别构作用的出现如同注入一针强心剂。“我们可以做出前所未有的尝试,”舍普强调说,“这种方法真的可以带来药物研发的变革。”
请 登录 发表评论