人类历史上最重要的科学革命是哪一次?大多数人都会把票投给中东人民在1万年前的伟大发现:他们首次观察到,植物种子掉进土里会长出新的植物——这一发现导致了农业的产生。而此前,人类主要以植物果实和块茎为食,偶尔能获得一些肉类。哪里有食物,就得向哪里迁移,不可能定居在某个地方。
发现种子的秘密后,人类很快就学会了种植农作物。他们将不同的植物杂交,培育出小麦、黑麦、大麦等主要粮食作物,得到了营养丰富、耐储存、可用于交易的粮食。人们终于可以和居无定所的游牧生活说再见,开始修建城邦。因此,第一个农业地区可算是“文明的摇篮”。
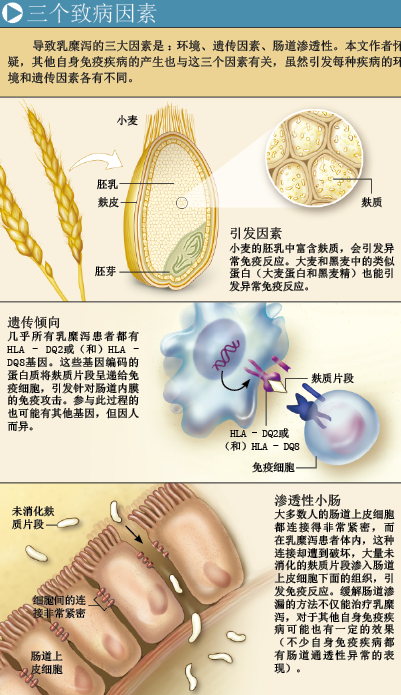
然而,人类也为这一巨大进步付出了代价:一种名为乳糜泻(celiac disease,CD)的疾病出现了。这种疾病由小麦中的一种蛋白质——麸质(gluten,也叫面筋)引发,黑麦和大麦中也有类似的蛋白质。人类饮食中曾一度缺乏麸质及类似物,但当小麦等主要粮食成为维系社会稳定发展的重要因素时,对麸质反应异常的人(常常是儿童)便深受其害。对于敏感个体而言,如果经常摄入这种蛋白,就不能正常地从食物中吸收营养,还不得不忍受反复发作的腹痛和腹泻,看起来就像身体瘦弱、腹部肿胀的饥民。营养不良和一系列并发症将大幅缩短他们的寿命。

即使当时的人们注意到,某些人会因为食用面食死亡,原因仍然是一个谜。过去20年来,科学家通过分析各种线索,对乳糜泻有了深入认识:这是一种自身免疫疾病(病人的免疫系统会攻击自身组织),该病的发生不仅与食用麸质及其类似物有关,遗传因素和小肠结构异常也是致病原因。
更重要的是,乳糜泻已成为我们研究自身免疫疾病的典型实例:在其他自身免疫疾病中,环境因素、遗传因素和肠道结构异常也可能起着重要作用。通过研究乳糜泻获得的新疗法,不仅能用于治疗乳糜泻本身,还有助于治疗1型糖尿病、多发性硬化症、风湿性关节炎等其他自身免疫疾病。
确定病因
农业产生后,又过了数千年,才有文献记载这样的病例:某些儿童看似衣食无忧,实际上却营养不良。公元1世纪,希腊医生阿勒特奥斯(Aretaeus of Cappadocia)首次对乳糜泻进行了科学描述,把该病称为koiliakos——希腊语中“腹部”(koelia)一词的衍生词。英国医生萨穆埃尔·吉(Samuel Gee)则被世人称为“现代乳糜泻之父”。1887年,他在一篇报告中如此描述乳糜泻:“一种所有年龄段的人都可能遭遇的慢性消化不良,尤其是1~5岁的儿童更容易受到影响。”他甚至准确地推测:“错误的饮食也许是致病原因之一。”尽管吉是一位睿智的医生,但还是没能发现真正的致病原因,因为他建议父母们给这些孩子喂食两面都烤过的薄面包片。
直到第二次世界大战后,人们才发现乳糜泻的致病因素。由于战争,当时荷兰国内的面包供应非常紧张,但该国儿科医生威廉-卡雷尔·迪克(Willem-Karel Dicke)敏锐地注意到一个与面包紧缺相关的现象——乳糜泻患儿的死亡率从高于35%下降为零。他撰文预测,一旦战争结束,小麦供应量恢复,乳糜泻患儿的死亡率还会上升到以前的水平。迪克的发现引起了其他科学家的注意,他们分析了小麦的各种成分后,终于确定小麦中的主要蛋白成分——麸质是引发乳糜泻的元凶。
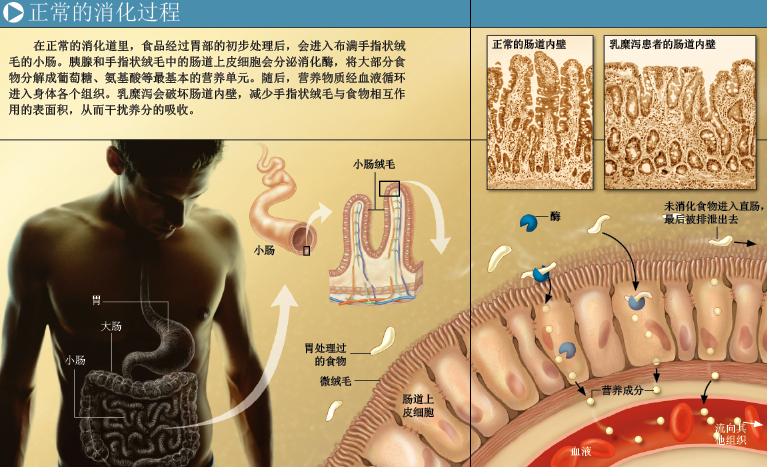
麸质会引发怎样的生物效应?科学家发现,如果乳糜泻患者经常摄入麸质,会致使手指状小肠绒毛发生慢性炎症,结构受到严重破坏,无法履行分解食物、通过肠道内壁将养分送入血液(再由血液运输至全身)的日常功能。不过,如果病人能得到及早诊治,食用不含麸质的食物,小肠结构会恢复到正常(或接近正常),胃肠道病状也会消失。
在敏感者体内,麸质会激活各种免疫细胞,引发肠道炎症,造成肠损伤。不仅如此,这些免疫细胞还会把健康组织当成病原体,发起猛烈攻击,损害人体健康。
诊断难题
虽然科学家还在更细致地研究麸质影响免疫活性的机制,但一项重要发现已在临床诊断中发挥着重要作用:针对组织型谷氨酰胺转移酶(tissue transglutaminase)的抗体的产生,是麸质引发异常免疫反应的标志之一。这种酶会从小肠发炎部位的受损细胞“漏出”,作用是修复邻近组织。
在乳糜泻患者中,组织型谷氨酰胺转移酶的抗体普遍存在,这为疾病诊断提供了新的工具,也让我们找到了评估发病率的新方法——检测患者血液中组织型谷氨酰胺转移酶的抗体。此前,医生的检测方法针对性不强,最可靠的方法也只是监测患者的症状,并通过肠道活组织检查,确认患者的肠道是否发炎,最后观察不含麸质的饮食能否缓解病情。检测人体内有没有麸质抗体,也不能判定一个人是否患有乳糜泻,因为这种抗体也可能存在于没患乳糜泻的人的体内。
科学家一直认为,在欧洲以外的地区,乳糜泻是一种罕见疾病,比如在北美,每1万人中平均不到1人会患乳糜泻。但在2003年,我们通过大范围调查发现,在全球大部分地区,乳糜泻的发病率都在0.33%~1%,比以前认为的要高几十甚至上百倍。其他科学家的研究也得出了类似的结论。
为什么在如此长的时间里,绝大部分乳糜泻患者都没能得到确诊?乳糜泻的典型症状——长期消化不良和慢性腹泻,只有在肠道出现大面积损伤、关键部位功能失常时才会出现,如果只是肠道的一小部分功能失常或轻度发炎,外在症状很可能不明显或不典型。
现已明确,由于乳糜泻患者肠道的养分吸收功能会遭到部分破坏,因而会表现出一系列症状,只是这些症状曾被人们忽略。铁吸收受阻,会导致贫血;叶酸吸收不畅,可导致多种神经问题。通过干扰某些特殊养分的吸收,乳糜泻还会导致更多症状,如骨质疏松、关节疼痛、慢性疲劳、身材矮小、皮肤损伤、癫痫、老年痴呆症、精神分裂症、抽搐等。
不过,由于乳糜泻的很多症状都不典型,许多病例无法确诊。而检测组织型谷氨酰胺转移酶的抗体这种新方法能在发病早期,对各种类型的乳糜泻作出准确诊断,让患者不再食用含有麸质的食品,防止发生更严重的并发症。
解密麸质
对于科学家而言,乳糜泻是研究自身免疫疾病的重要“模型”,因为只有这一种疾病,科学家能通过增加或去除一个简单环境因素——麸质,启动和终止疾病进程。(虽然环境因素也可能在其他自身免疫疾病中发挥作用,但还没有得到证实。)
要弄清楚麸质为什么会损害某些人的健康,就得了解这些人摄入麸质后,身体会作出何种反应。健康人不会对麸质产生反应,只有检测到身体内存在大量外源蛋白时,正常的免疫系统才会被激活,因为外源蛋白可能是病原微生物(如细菌或病毒)进入人体的信号。
我们接触外源蛋白和其他物质的主要途径是饮食,因此肠道上皮细胞下面的“免疫士兵”随时准备投入战斗,并向“总部”请求增援。但免疫系统并没有因为我们的每日三餐,每天就被外源蛋白激活三次,其中一个重要原因是:免疫系统在遇到这些蛋白前,胃肠道系统就已经把它们分解为氨基酸——合成所有蛋白质的原材料。
麸质的特殊之处在于,它富含谷氨酰胺(glutamine)和脯氨酸(proline),不易被“蛋白粉碎机”完全降解,会产生一些较小的蛋白片段(即肽段,peptide)。在健康人体内,这些片段会短暂滞留在肠道内,并在免疫系统发现之前随其他食物残渣被排泄出去。即使一些麸质片段能穿过肠道内壁,但由于数量太少,它们也不足以刺激免疫系统作出强烈反应。
乳糜泻患者体内却先天具有一些基因,提高了人体对麸质的免疫敏感性。某些突变基因通过编码组织相容性白细胞抗原(histocompatibility leukocyte antigen,HLA)来发挥作用。95%的乳糜泻患者都有编码HLA—DQ2或HLA—DQ8蛋白的基因,正常人中拥有这两个基因的比例约为35%~40%。这一结果和其他研究表明,编码HLA—DQ2或HLA—DQ8的基因不是免疫活性过高的唯一原因,然而若没有其中任何一个,乳糜泻都不可能发生。对于乳糜泻而言,这两个基因为什么如此关键?通过研究它们编码的蛋白质,科学家已找到了答案。
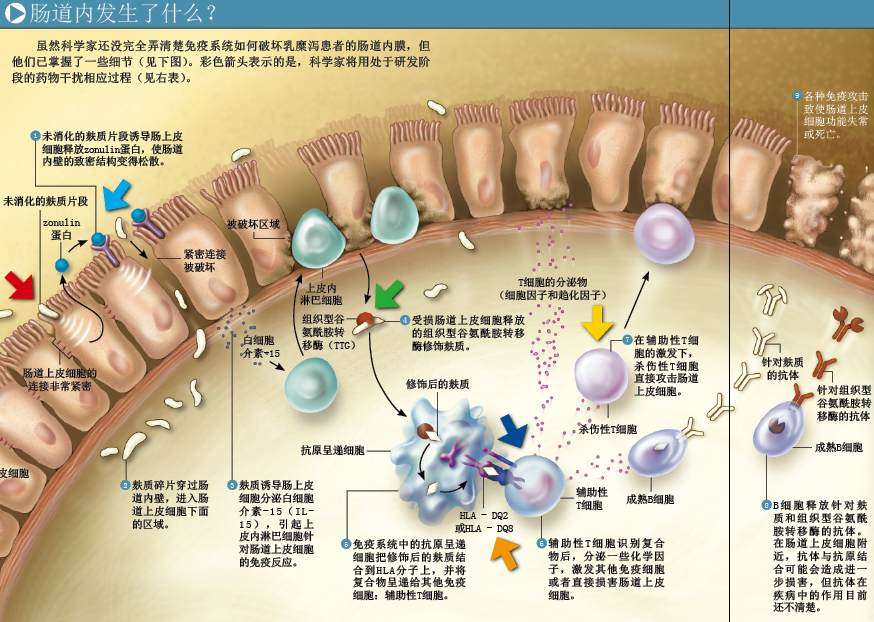
HLA—DQ2和HLA—DQ8由抗原呈递细胞(antigen-presenting cell)合成,作用相当于“免疫哨兵”,能吞噬外源微生物和蛋白质,将它们降解成片段,并把特定片段结合到HLA分子的凹槽上。最后,这个含有外源蛋白片段的蛋白质复合体会出现在抗原呈递细胞表面,展示给辅助性T淋巴细胞。T细胞识别出外源蛋白片段后,就会与蛋白复合体结合,并召集其他免疫细胞和分子。
在乳糜泻患者体内,肠道上皮细胞释放的组织型谷氨酰胺转移酶会与麸质片段结合,改变这些片段的结构,让它们能与HLA—DQ2和HLA—DQ8蛋白极其紧密地结合。当肠道上皮细胞下面的抗原呈递细胞发现组织型谷氨酰胺转移酶和麸质片段形成的复合体,就会与之结合,并让麸质片段与HLA结合在一起,将它们呈递到细胞表面,激活T细胞,促使这类免疫细胞释放细胞因子(cytokine)和趋化因子(chemokine,这两种化学因子都能进一步刺激免疫活性)。正常情况下,化学因子和增强的免疫防御能有效抵御微生物的攻击,但麸质激发的免疫反应对人体没有任何好处,反而会损害具有养分吸收功能的肠道细胞。
乳糜泻患者往往还具有其他致病性遗传因素,比如易于产生过量的免疫刺激因子IL-15;常拥有过度兴奋的免疫细胞——在麸质引发的免疫反应中,这些细胞是攻击肠道的主要成员。
肠道内壁上的漏洞
在麸质引起的病理反应中,组织型谷氨酰胺转移酶的抗体发挥了什么作用?科学家至今还未完全弄清楚。当肠道上皮细胞释放组织型谷氨酰胺转移酶后,B细胞会将这些酶吞掉(部分酶可能还结合有麸质片段),产生相应抗体。若组织型谷氨酰胺转移酶的抗体位于肠道上皮细胞及其附近,就可能直接损害上皮细胞或引发其他有害的生理反应。但事实上,科学家并不知道上述抗体是否真的会损害肠道。
过去9年里,我和同事认识到,肠道内壁通透性异常,似乎也与乳糜泻和其他自身免疫疾病有关。越来越多的证据表明,大多数(或许是所有)自身免疫疾病的产生都有三个相同的诱发因素:出现在人体内的外界物质;由于遗传因素,免疫系统易对这种物质作出过度反应;肠道内壁的通透性异常。
肠道内壁通透性异常,会导致乳糜泻和其他自身免疫疾病——最初,这个理论受到很多科学家的质疑,但考虑到人们对肠道的原有认识,受到质疑也属正常。上世纪70年代,当我还是一名医学专业的学生时,教科书把小肠描述为一根由单层细胞构成的管道,这些细胞紧密连接在一起,就像用水泥和砖块砌成的一样。人们普遍认为,肠道细胞间的连接过于紧密,除了小分子以外,其他物质根本无法接触到位于“管道”下面的免疫系统。对于这种连接紧密、通透性不强的简单模型,大多数科学家都没兴趣研究它的结构,我也不例外。
在事业陷入低谷时,我的命运发生了一个意外转折,促使我开始研究肠道的致密结构。20世纪80年代末,我在研究霍乱疫苗。霍乱的典型症状是足以致命的严重腹泻,当时的科学家认为,霍乱毒素(cholera toxin)是导致这种腹泻的唯一原因。为了验证该观点,我的研究团队敲除了霍乱弧菌(Vibrio cholerae)中编码霍乱毒素的基因。传统观念认为,由基因敲除得到的减活病菌(即致病力降低)是最理想的疫苗,因为活病菌上的蛋白质会在人体内引发强烈的免疫反应,从而预防腹泻。
但当我们在自愿者身上使用减活病菌时,却引发了严重腹泻,活病菌疫苗的研究被迫终止。多年的研究付诸东流,我非常沮丧。摆在我们面前的,只有两条前景不太光明的道路:放弃该研究,转向别的领域;坚持下去,找出失败的原因。直觉告诉我,我们并未身处绝境,探险远未结束,因此选择坚持。正是这一决定,让我们发现了一种新的毒素,它能以一种全新的机制引发腹泻:该毒素会破坏肠道内壁的致密结构,改变肠道通透性,让组织液渗入肠道。我们的热情又被激发出来。
与此同时,一系列开创性研究发现,肠道内壁的致密结构是由一个复杂的蛋白质网络形成的,但人体如何调控这一形成过程仍然是未知的。我们发现的新毒素成为了阐明上述调控机制的重要工具——我们把它称为 “zonula occludens毒素”,简写为Zot(在拉丁语中,zonula occludens意为紧密连接)。研究显示,单个Zot分子就能使复杂、致密的肠道内壁结构变得松散。我们还发现,尽管调控系统允许肠道内壁变得松散,但系统本身非常复杂,轻微的改变不会对人体造成危害。因此,霍乱弧菌必定是利用另一种人体机制来调控肠道通透性,从而引起腹泻。
提出该假说5年后,我们发现了一种在人类和其他高等动物体内都存在的蛋白质zonulin,它能利用与Zot分子相似的机制改变肠道通透性。除了肠道上皮细胞,其他器官的细胞也会分泌这种蛋白(人体任何组织都需要致密结构),但它们在人体内发挥什么作用还有待确定。我们推测,zonulin分子很可能具有多种功能,比如调节体液、大分子和免疫细胞在人体不同部位间的移动。
zonulin的发现让我们联想到,是否还有其他以肠道通透性增强为特征的疾病?我们开始查阅相关医学文献。我们惊讶地发现,包括乳糜泻、1型糖尿病、多发性硬化症、类风湿性关节炎和炎性肠道疾病在内的很多自身免疫疾病都有一个共同点:肠道通透性异常。在这些疾病的患者中,肠道通透性增强都由浓度异常高的zonulin蛋白导致。现在我们已经知道,在乳糜泻患者的体内,麸质会促进zonulin蛋白的分泌(可能与患者的基因组成有关)。
根据这一发现,我们推测,由于肠道通透性增强,环境影响因子——麸质就能渗透到肠道内壁后面,与高度敏感的免疫系统成员发生相互作用。这也告诉我们,只要消除引发自身免疫疾病三大因素中的任何一个(即环境因素、过度敏感的免疫活性或过强的肠道通透性),应该都能终止乳糜泻的进程。
治疗乳糜泻
正如我们提到的,只要坚持食用不含麸质的饮食,最终就能治愈肠道损伤。然而,对于病人而言,出于治病的考虑而长期坚持食用无麸质食品无疑是个巨大的挑战。在很多国家,有关部门都没规定食品标签中必须显示麸质含量,无麸质食品不多,价格也比普通食物更高。因此,食疗并不是最好的解决方案。
科学家已在研究其他治疗策略,至少“屏蔽”三大致病因素中的一个。美国加利福尼亚州圣卡洛斯市的Alvine制药公司开发了一种 “蛋白质—酶”口服制剂,能完全降解通常难以消化的麸质片段,目前该制剂已进入临床试验阶段。其他研究人员则在考虑如何抑制组织型谷氨酰胺转移酶,使它不能修饰未消化的麸质片段,阻止后者与HLA—DQ2和HLA—DQ8蛋白结合。
虽然还没有找到安全且符合伦理的方法来操纵乳糜泻相关基因,但科学家正致力于开发能降低病人免疫系统敏感度的疗法。澳大利亚Nexpep公司就在研制一种疫苗:利用少量刺激性很强的麸质去激发人体免疫系统。理论上,经受小剂量麸质的多次刺激后,免疫系统对麸质的敏感度就会降低。
我参与创建的阿尔巴医疗公司(Alba Therapeutics)正在研究zonulin蛋白的抑制剂Larazotide,希望用它阻止zonulin蛋白破坏肠道内壁(我现在是阿尔巴的科学顾问,拥有公司股票期权,但不再参与公司决策)。目前,我们公司已开展了两项人体试验,来检验Larazotide的安全性、有效性以及人体对Larazotide的耐受性。试验中,我们使用了随机的安慰剂对照试验——在试验结束前,无论是研究人员还是病人,都不知道谁服用了药物,谁服用了安慰剂,这是人体试验的黄金准则。
两项试验的结果都显示,与安慰剂相比,Larazotide并没有产生更多的副作用。更重要的是,针对乳糜泻患者的小规模研究表明,这种药物不仅能缓解由麸质引发的肠道内壁损伤,还能减少炎症分子的分泌量,减轻胃肠道症状。在2009年4月一次学术会议上,我们报道了大规模研究的结果:服用安慰剂的乳糜泻患者产生了组织型谷氨酰胺转移酶的抗体,而治疗组的患者没有这类抗体。我认为,这一结果标志着,通过特异性干扰针对人体自身特定分子的免疫反应,Larazotide成为了首个能终止自身免疫疾病进程的药物。其他能抑制免疫活性的药物根本不具备“特异性”,不能针对某一类分子发生作用。最近,美国食品及药品管理局批准阿尔巴公司扩大试验范围,可将Larazotide应用于1型糖尿病、克罗恩病等其他自身免疫疾病的治疗。
新疗法具有不错的前景,但并不意味着乳糜泻患者可以很快摆脱饮食的限制,因此食疗也必须有新方式。在卡洛·卡塔西(carlo Catassi)的领导下,我在美国马里兰大学的团队已展开了一项长期临床研究。在乳糜泻高危婴儿出生后的第一年,研究人员和孩子的父母商定,只给孩子喂食无麸质食品,然后观察这样是否可以延迟疾病发作,或起到预防作用。乳糜泻高危婴儿是指,这些孩子拥有疾病相关基因,或有直系亲属曾患过乳糜泻。
我们认为这个办法可行,因为在出生后的12个月里,婴儿的免疫系统发育得非常快,而且对高危婴儿的研究表明,在1岁前避免摄入麸质(而不是用麸质过度刺激),能让他们处于发育中的免疫系统逐渐变得和正常人一样,都能对麸质产生耐受性。到目前为止,我们已接纳了700多个遗传因素导致乳糜泻患病几率较高的婴儿。初步调查结果显示,不让孩子过早摄入麸质,能使乳糜泻患病几率降为原来的1/4。不过,只有等到几十年后,我们才能确定这种方法是否可以真正阻止乳糜泻的发生。
由于自身免疫疾病具有一些明显的共同点,科学家非常希望针对乳糜泻的治疗策略也能用于其他自身免疫疾病的治疗——目前,不少自身免疫疾病均没有很好的治疗方法。同时,我们也希望,处于临床试验阶段的几种治疗乳糜泻的方法,能在本世纪内彻底消灭这种伴随人类文明而出现的疾病。
请 登录 发表评论