降血压药驯服癌症
压迫血管的癌细胞和细胞外基质,会阻碍抗癌药物输送到癌细胞。
现在,研究人员可能有办法清除基质,恢复药物的治疗功效。
撰文 拉凯什 · K · 贾因(Rakesh k . Jain) 翻译 毛玉玲 审校 杨霞
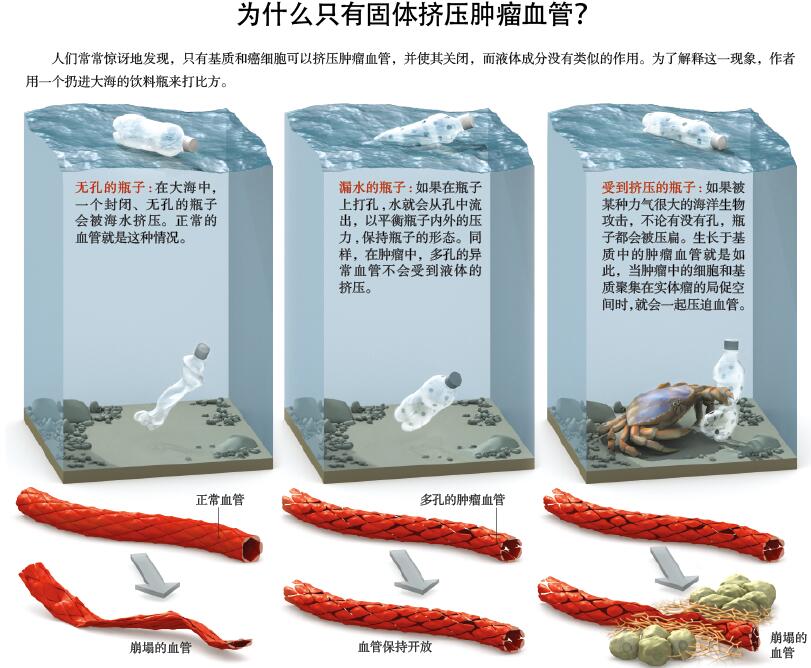
举个例子,二十多年前,我和同事在卡内基梅隆大学发现,肿瘤血管的异常结构会干扰药物向肿块中癌细胞的输送。这些血管往往有许多小孔,并且过度弯曲,随着血管逐渐深入肿块,这种多孔的特性使得血液中的液体和药物很容易渗出;反过来,渗出的液体对肿瘤施压,又会导致更多的药物分子从肿瘤向周围组织渗漏。我们后来发现,减少血液的泄漏,会降低这种“组织间隙液压”(interstitial fluid pressure),从而改善药物在肿瘤中的输送,提高肿瘤细胞对各种治疗方法的敏感性。
我们最近的研究表明,液体压力并不是唯一影响肿瘤生长的物理作用力。肿瘤是由恶性细胞、非恶性细胞、血管和淋巴管组成的混合体,它们一同嵌合在一种名叫“细胞外基质”(extracellular matrix)的纤维组织中。细胞和细胞外基质可以压迫血管和淋巴管,物理学家和工程师将这种压迫力称为“固体压力”(solid stress),它可能会减少、甚至阻止血液流向肿瘤组织,继而减少药物的输送,形成更有利于促进癌症发展的环境。同时,肿瘤中的细胞外基质异常僵硬,在某些肿瘤组织中异常丰富,能直接阻碍抗癌药物在肿瘤组织中的扩散。
了解了肿瘤基质的各种危害之后,我的团队最近一直在寻找对付它的方法。我们发现了一个有趣的方向。说它“有趣”,一定程度上是因为它依赖于一类大家熟知的“安全药物”——抗高血压药。研究人员正在进行临床试验,测试这种疗法是否能对一种胰腺癌产生疗效,这种胰腺癌是基质最为丰富、最难治疗的一种恶性肿瘤。
当然,我们不能保证“基质降解药物”一定能引发革命性的突破。实际上,癌症是许多种令人难以捉摸的疾病的集合体。许多时候,癌症患者体内的肿瘤是难以彻底清除的,但是,如果抗高血压药物能达到我们预期的效果,它们就能有效延长癌症患者的寿命。
搜寻良药
认识到受压的肿瘤血管和淋巴管会导致一系列惊人的不良后果后,我开始考虑对肿瘤基质进行干预。正常情况下,淋巴管能排出肿瘤和其他组织中多余的液体,但当肿瘤中的淋巴管受到挤压,淋巴管便不能排出从肿瘤血管中渗漏的液体, 组织间隙液压也会因此上升。同时,受压的状态降低了已然受损的血管向恶性病灶输送血液、氧气、免疫细胞和抗肿瘤药物的能力,并且形成了许多缺氧的区域。
这种含氧量降低(也就是“缺氧”)的状态,似乎能够阻断肿瘤的生长——听起来像是一件好事。但实际上,缺氧可能造成相当严重的后果。缺氧可能刺激肿瘤恶化,甚至可以让正常细胞分泌一些蛋白质,抑制抗肿瘤免疫细胞的活性。血管内皮生长因子(vascular endothelial growth factor,缩写为VEGF)就是这样一种蛋白质,它能够增加血管的通透性,从而进一步减少肿瘤组织中的血液循环,提高组织间隙液压。此外, 缺氧也能改变一些免疫细胞的功能,使它们由肿瘤的“击杀者”变成“帮凶”。
不仅如此,那些侵袭和扩散能力最强的癌细胞,在缺氧条件下更容易存活下来,因为在氧气稀缺时,危险性较低的细胞更倾向于“自我了断”。更糟糕的是,缺氧会增加癌细胞的侵袭倾向——例如诱导癌细胞产生一些蛋白质,帮助其脱离原位组织。另外,缺氧也会破坏许多抗癌药物的功能。
肿瘤基质造成的危害,并不仅限于造成缺氧和削弱药物的输送。我的团队最近发现,压迫力会诱使一些癌细胞变成入侵附近组织的“领头羊”,并诱导其他细胞随之转移、扩散。此外,压迫力和肿瘤基质还会形成一个恶性循环:压迫和缺氧都可以刺激“基质形成细胞”(matrix-producing cells,比如成纤维细胞),提高它们的活性,甚至还能刺激某些不参与肿瘤基质形成的非恶性细胞分泌基质成分。
可以肯定的是,我的团队在开始肿瘤基质方面的研究之前,就已经清楚缺氧带来的后果,并且优先研究了改善缺氧的方法。大约13年前,我们首次提出了“血管正常化”的概念,即降低肿瘤血管的扭曲性和通透性,这样一来,就可以改善肿瘤组织的血流灌注(blood perfusion,指单位时间内流入的血液量),降低组织间隙液压,从而改善组织缺氧的情况,促进药物和免疫细胞向肿瘤组织的输送。通过动物实验和人体试验,我们已经找到了支持这一假设的确实证据。事实上,我们已经证明,利用抗血管新生药物(antiangiogenic drugs,可以抑制新生血管的形成),恢复血管的正常特性,可以增加传送到脑部肿瘤的血流量和氧气,更重要的是,这可以延长一些病人的生存时间。这种机制还可以解释,为何联合使用抗血管新生药物贝伐单抗(bevacizumab)和化疗药(即杀死癌细胞的药物)或者免疫疗法(即增强人体对肿瘤的免疫反应),能够延长结肠癌、肺癌和肾癌患者的生存时间。
研究人员还在继续优化这种治疗方案,但单靠这一种疗法显然是不够的。因为在肿瘤组织内部,压迫血管和淋巴管的并非组织间隙液压,而是肿瘤中的细胞和细胞外基质。当渗漏血管周围的组织间隙液压提高时,液体可以通过毛细血管孔,渗回血管内部,而不会把血管压碎 (见54页“肿瘤物理学”)。而且,抗血管新生药物也无法重新打开因癌细胞和细胞外基质压迫而关闭的血管。我们的研究正是要克服这些问题,清除细胞外基质,缓解固体压力。
在寻找可能清除细胞外基质的药物之前,我们首先要更清楚地知道,不同肿瘤中,细胞外基质的含量有何差异,这些实体组分又会产生多大的压力。我们发现,不同类型的癌症在这方面的差异非常显著——尽管在显微镜下,许多人类肿瘤组织中都存在一些崩塌的血管。
血管崩塌的程度,部分取决于肿瘤的阶段和位置。例如,狭小的空间会增加压迫力。在这些地方,部分或完全崩塌的血管数量均会增加。肿瘤的类型也会影响血管崩塌的程度,以胰腺癌中最常见的胰腺导管腺癌为例,肿块中包含大量的肿瘤基质和成纤维细胞,癌细胞相对较少,仅占肿块的5%;而其他癌症(如儿童脑癌中最常见的髓母细胞瘤)通常仅含有少量肿瘤基质。一般来说,那些基质和成纤维细胞比例较高的肿瘤,药物治疗效果较差。这就表明,减少这些肿块中基质的量,可以增加药物到达治疗靶点的机会,从而达到更好的治疗效果。
去除基质压迫
我的团队能够找到清除细胞外基质的药物,多亏了一个偶然的发现。细胞外基质由蛋白质纤维(主要是胶原蛋白)和凝胶状物质(如透明质酸)组成。科学家一度认为,透明质酸比胶原蛋白更能干扰药物向肿瘤的运输。但在2000年,我们吃惊地发现,在干扰药物输送方面,组织硬化的作用更为重要,而组织硬化正是取决于组织中胶原蛋白的含量。我们还发现,用胶原酶将蛋白质纤维降解,可以大大增加一种直径150纳米的微粒(在实验中用来代替药物)的扩散能力——即便在药物最难穿透的肿瘤中也是如此。我们用这样大小的纳米粒子,代替抗癌的纳米药物进行实验,但迄今为止,取得的成果不大。我们接下来的研究显示,当我们向小鼠体内同时注入破坏胶原蛋白的胶原酶和150纳米的病毒颗粒(用于杀伤癌细胞)时,小鼠体内肿瘤的萎缩程度,比只注入病毒颗粒 (没有注入胶原酶)时更明显。
与结果同样有趣的是,我们知道,如果药物将人体内的胶原蛋白全都降解了,那将会造成很大的问题,因为胶原蛋白是我们的骨骼与组织的结构成分。我们需要一种更安全的药物,它只能作用于肿瘤,而不会对全身产生广泛的影响。不过,哪里有这样的药呢?
很快,我们想到了一种叫做松弛素(relaxin)的激素。这是女性在怀孕期间产生的一种激素,能抑制胶原蛋白的合成,并促进其降解。准妈妈们能分泌很多松弛素,而这并没有对她们的身体造成不好的影响。因此我们猜想,能否利用松弛素降解肿瘤中的胶原蛋白?
2002年,我们用松弛素对荷瘤小鼠(tumor-bearing mice)进行了两周的治疗。果然,它能够重构胶原蛋白,使其变得更加多孔,并且改善我们用以替代药物的大分子在肿瘤中的分布。一些研究人员研究了其他类型的肿瘤,进一步证实了我们的结论。但我们后来的研究显示,松弛素可以加速某些肿瘤的恶化进程,如前列腺癌。考虑到结果的差异和所涉及的风险,我们不可能在人体中进行这样的试验。
抗高血压药的新用途
失望过后,我们开始寻找其他药物。我们决定专攻促进细胞合成胶原的关键蛋白:转化生长因子β(transforming growth factor beta,TGF-β)。我们发现,用于治疗高血压的药物一般不只会降低血压,它们在人体内通常还会产生另一种作用:抑制TGF-β的活性。此外,作为血管紧张素受体拮抗剂,这些用来治疗高血压的药物还可以破坏另一种参与胶原稳定过程的分子的功能。我们知道,包括洛沙坦(losartan)在内的许多血管紧张素受体拮抗剂,可以降低细胞外基质过量的实验动物体内多种胶原的水平,并且能减小高血压患者心脏和肾脏的负荷。然而到目前为止,我们没有找到任何已发表的文献,报道这些药物对胶原蛋白水平或肿瘤固体压力的影响。
为了确定血管紧张素受体拮抗剂能否降解肿瘤中的基质,从而改善抗肿瘤药物在肿瘤组织中的分布,我们给4种荷瘤小鼠(分别带有胰腺导管腺癌、乳腺癌、黑色素瘤,以及结缔组织中产生的肉瘤,这4种肿瘤都富含基质)用洛沙坦给药两周,得到了两个令人兴奋的结果。首先,肿瘤中的胶原蛋白减少了;其次,我们用来替代靶向杀伤癌细胞药物的直径100纳米的微粒,在肿瘤组织中扩散得更广泛了。我们推断,替代药物的纳米微粒之所以可以更好地渗透,是由于胶原蛋白的含量减少了。2011年发表的一篇研究论文中,研究人员用真正的药物——美国食品及药品管理局(FDA)批准的靶向抗癌药物多喜 (Doxil,直径约100纳米的阿霉素脂质体),以及病毒颗粒(直径约150纳米),在啮齿类动物中进行了后续研究,得到了同样的结果。
在研究过程中,我们还发现,洛沙坦的剂量越高,降解胶原的作用就越大。出现这样的剂量依赖性是一个好迹象,因为我们可以用不同剂量的药物,来观察不同的疗效。这一发现也暗示, 提高洛沙坦的浓度可以更好地降解胶原蛋白,从而使富基质肿瘤中的血管开放到足够的程度,以便抗癌药物更好地通过肿瘤血管,到达从前没有血液流过的大片肿瘤区域。事实证明,对乳腺癌小鼠和胰腺癌小鼠给药两倍剂量的洛沙坦,进一步开放血管,能提高纳米药物以及标准化疗药物的输送和药效。
接下来我们想知道,在人类癌症患者身上,高剂量的洛沙坦或其他抗高血压药会不会增强常规化疗药和纳米药物的疗效。虽然我们还没有明确的答案,但我们有理由相信这一可能性。过去,对那些同时接受抗肿瘤药物和抗高血压药物治疗的患者(这些患者不仅患有癌症,同时也有高血压)的研究显示,某些抗高血压药物似乎能在一定程度上提高抗癌效果。例如,一项对过去研究的统计分析表明,相对于单独进行化疗,联合使用抗癌药物吉西他滨(gemcitabine)和血管紧张素受体拮抗剂(或某些相关酶抑制剂),可以使胰腺导管腺癌患者的总生存期延长大约6个月。
当然,回顾性研究自有其局限性。但是,接受高血压治疗的癌症患者的数据,与我们在小鼠中的发现是一致的,这为研究人员在人体中检测血管紧张素受体拮抗剂能否作为降解基质的药物提供了基础。美国麻省总医院的一个研究团队已经开始了一项临床试验,联合使用洛沙坦和标准化疗,治疗胰腺导管腺癌(这种癌症患者的五年生存率不到6%),试验将在几年内得出结果。未来,如果一切顺利,我们便可以联合使用血管正常化药物 (例如VEGF受体拮抗剂)、基质降解药物和靶向抗癌药物,大大提高癌症治疗效果。
和大多数药物一样,抗高血压药物也有一些副作用,它们不能用于有肾脏疾病或低血压的癌症病人。即便对于血压正常的患者,使用的剂量也需要严格监控,以免造成严重的血压下降。要解决这个问题,我们可以想办法对血管紧张素受体拮抗剂进行修饰,使它们既能降解基质,又不会降低血压。我们正在朝这个目标努力。然而,对大多数药物,肿瘤往往会产生耐药性。肿瘤是否会对洛沙坦或其他血管紧张素受体拮抗剂产生耐受,还是个未知数。
备选方案
那么,对于那些不能服用降压药,或者即便可以服用,但药效不明显或不持续的癌症患者,我们又该怎么办?将肿瘤中非纤维性的透明质酸分子作为靶点,也许是另一种对付肿瘤基质的方法。大约25%的人类癌症中存在大量透明质酸,如胰腺导管腺癌、乳腺癌、结肠癌和前列腺癌。我们最近发现,一种可以降解透明质酸的透明质酸酶,确实可以减少荷瘤小鼠体内肿瘤组织中的固体压力。我们的研究结果已经表明,洛沙坦也可以减少肿瘤中的透明质酸。其他研究人员也已经证明,透明质酸酶可以降低血压。在这些研究的基础上,科学家正在进行临床试验,检测一种名叫PEGPH20的酶对胰腺癌的疗效。利用某些具有基质降解作用的药物,我们和许多研究团队的实验室研究都取得了一定成果。
为了完善基质降解疗法,研究人员需要一些方法,检测各种药物对肿瘤基质的实际影响。破坏肿瘤基质的物质真的会减少血管周围的压迫力吗?哪些药物最有效?基质减少的程度真的能影响传统抗癌药物的运输效果吗?对这些问题的研究,已经取得了一定的进展。一种名叫“二次谐波成像”(second-harmonic generation)的新方法,可以帮助研究人员发现和测量肿瘤中的胶原蛋白。此外,我们已经找到一个相对简单的方法,可以测量肿瘤中的压力。当我们从实验动物体内取出一块肿瘤,将其一切为二时,两个小肿块会自发地膨胀。测量小肿块的膨胀程度,再应用数学公式进行计算,我们就可以得到肿瘤内部压力的大小。
我时常在想,细胞外基质降解后,癌细胞会不会更容易穿过基质,进入血管和淋巴管,转移到身体的其他部位呢?同样,人们也在怀疑,当基质降解、血管疏通之后,流经肿瘤的血流量增加,是否有助于癌细胞逃逸,进入循环系统?癌细胞从血液中得到更多营养物质之后,会不会生长得更快?这两种情况会同时发生吗?要解答这些问题,我们还需要进一步的研究。然而,一些研究结果已经表明,将血管正常化,能够缓解肿瘤中的压力,并且,这种治疗方法不会促进肿瘤的生长和转移。为什么?一方面,确实会有更多的营养物质输送到癌细胞, 增强其迁移能力;但另一方面, 正常化的血管可以缓解缺氧的状况,而缺氧可以促进肿瘤恶性化发展,破坏免疫反应,削弱许多疗法的效果——这些负面影响均会随着血管的正常化而减弱。此外,肿瘤血管的正常化,可以提高大量药物和免疫细胞在循环系统中的扩散能力。开放血管的效果,足以抵消该疗法对肿瘤生长的促进作用。正在进行的动物实验和人体试验,将会揭示哪一种影响更加重要。
继续探索
回头想想,当我和同事最早开始考虑用血管紧张素受体拮抗剂对抗癌症时, 我们曾经咨询过一些人,他们都不看好我们的思路。顾名思义,抗高血压药显然会导致肿瘤血流量下降,而非上升。此外,许多小鼠实验和人体试验表明,血管紧张素 (与血管紧张素受体拮抗剂不同,这类药物会导致血压上升)会增加肿瘤血流量。然而,那些研究没有考虑基质对血管的压迫作用,而且,一个评估血管紧张素对癌症的治疗效果的临床试验也遭遇了失败。几年后,我们找到了那次失败的原因:据我们推测,在药物作用下,来自基质的压力使血管迅速关闭,血流的上升只是暂时的。
放眼未来,身为癌症研究人员的我们,需要的不仅是更好地理解癌症的遗传和细胞机制,还应当考虑肿瘤所受到的物理压力。我们需要充分利用这些知识,认识肿瘤发展的规律,改善癌症检测和治疗方法。肿瘤能够借助物理力量生存,而现在,我们也应该利用物理学知识进行反击!
本文译者 毛玉玲是中山大学中山医学院生物化学与分子生物学专业博士,师从杨霞教授。
本文审校 杨霞是中山大学中山医学院教授、博士生导师,研究方向为血管增生性疾病的分子机制。
请 登录 发表评论