由毒性蛋白质引发的级联反应也许可以解释阿尔茨海默病、帕金森症和其他健康杀手的病理机制,这可能暗示了一种新的神经疾病疗法。
撰文:拉里·C·沃克(Lary C. Walker) 马蒂亚斯·尤克尔(Mathias Jucker)
翻译:李艳芳、张弦、张云武、许华曦
朊病毒是神经细胞里构象发生了某种持久改变的特定蛋白质,它们错误地折叠,继而引发级联反应,感染其他蛋白,使之发生同样的构象变化并聚集成块,最终侵噬整个脑区。过去10年里,科学家通过研究发现,朊病毒的这种侵噬方式可能并不局限于疯牛病,更可在阿尔茨海默病、帕金森症、肌萎性脊髓侧索硬化症(amyotrophic lateral sclerosis,简称ALS)等主要神经退行性疾病中发生,足球运动员、拳击手中常见的由脑震荡引起的痴呆症中,也有类似的病理过程。
但不同于疯牛病或流感,所有证据都表明,阿尔茨海默病和帕金森病并无传染性。上述这些发现的重大意义在于,科学家找到了许多大脑疾病的主要元凶,为寻求最终治疗方案指明了道路。以这些病理过程为作用目标研发的阿尔茨海默病药物,在未来可能直接用于帕金森病、脑外伤或其他可能夺去个人基本自我意识的可怕疾病,或至少可以大大促进这些病症的药物研发。这对于正在饱受神经退行性疾病折磨的患者,无疑是个难得的福音。
这个新观点的建立,得益于人们对朊病毒的研究。该研究起源于18世纪早期广泛在欧洲和澳洲传播的“羊瘙痒症”(scrapie)。这是一种奇怪的致死疾病,患病动物因奇痒难熬,会不由自主地反复摩擦自己的毛发。然后,随着对该病的研究日渐深入,科学家在显微镜下观察发现,患病动物的神经系统布满了孔洞。20世纪30年代,法国和英国研究者发现,羊瘙痒症可在羊之间传染,但传染因子的传染途径却相当古怪,难以捉摸。相对于通常的致病因子,如细菌或病毒,羊瘙痒症的传染因子在接触传染源到疾病暴发之间的潜伏期更长,并且机体负责驱逐外来致病因子的免疫反应也丝毫不起作用。
这些古怪特征暗示,平常的致病因子并不是羊搔痒症的元凶,但在此后的20多年间,对羊搔痒症的研究并未取得任何实质性进展。直到20世纪50年代,威廉·哈德洛(William Hadlow)在英国农业研究理事会(Agricultural Research Council,ARC)上提出,从病理学的角度看,羊搔痒症与一种神秘的人类疾病——库鲁病(kuru),具有非常明显的相似之处。库鲁病是一种进行性的神经退行性疾病,主要出现在巴布亚-新几内亚的法尔(Fore)族人身上。该病会导致患者机体协调性降低、神经异常和痴呆,最后死亡。现在已经发现,这一疾病之所以会在法尔族人中传染,是由于该土著部落有食用已故亲人脏器的习俗,他们吃了死于这种疾病的部落成员的尸体所导致。这意味着,某些传染性病原体可以从身体的其他部位到达大脑,进而引发疾病。
20世纪60年代,美国国立卫生研究院的神经科学家D·卡尔顿·盖杜谢克(D. Carleton Gajdusek)和同事证实,通过直接注射患者大脑物质的方式,可以让非人灵长类动物染上库鲁病。盖杜谢克的团队还发现了库鲁病和另一种神经退行性疾病,克雅氏病(Creutzfeldt-Jakob disease,CJD)在病理学上的相似之处。克雅氏病是一种快速传播的痴呆症,在世界范围内发病率约为百万分之一。盖杜谢克进一步证实,虽然克雅氏病通常发生在人类身上,但同库鲁病一样,克雅氏病也可在灵长类动物之间传播。
直到上世纪80年代,美国加利福尼亚大学旧金山分校的生物学家斯坦利·B·普鲁辛纳(Stanley B. Prusiner)才终于鉴定出羊搔痒症等疾病的致病因子。这类疾病能使大脑呈现如瑞士奶酪一样的空泡状,因此通常被称为海绵样脑病。基于一系列几近完美的实验,普鲁辛纳和同事得出了极具说服力的证据,证明致病因子仅由一种错误折叠的蛋白PrP构成,而这种蛋白在正确折叠时无致病性。普鲁辛纳将这种蛋白称为“prion”,即朊病毒,意思是“蛋白质传染颗粒”,以此与病毒、细菌、真菌和其他已知病原菌的自身蛋白质相区别。(如今,朊病毒的范畴已经扩充,还包含那些虽能使其他蛋白发生与自身相同的构象改变,但不一定具备传染性的蛋白质。)普鲁辛纳提出蛋白质自身可传染疾病的新观点后,立刻引发了一场激烈的争论。但在1997年,普鲁辛纳由于在朊病毒研究上做出的卓越贡献,获得了诺贝尔生理学或医学奖。
关于阿尔茨海默病和其他神经退行性疾病的最新研究成果表明,尽管这类疾病不具有典型朊病毒病的传染性,但可能具有相似的致病途径,即致病蛋白质在大脑中“播种”。与引起羊搔痒症等疾病的朊病毒一样,这些蛋白质“种子”可由细胞释放、积聚和转运,这也解释了为什么疾病可从身体的一个区域扩散到另一个区域。同时,这种传播途径上的共性暗示,朊病毒机制可统一大家对各种神经退行性疾病发病、肆虐途径的看法。
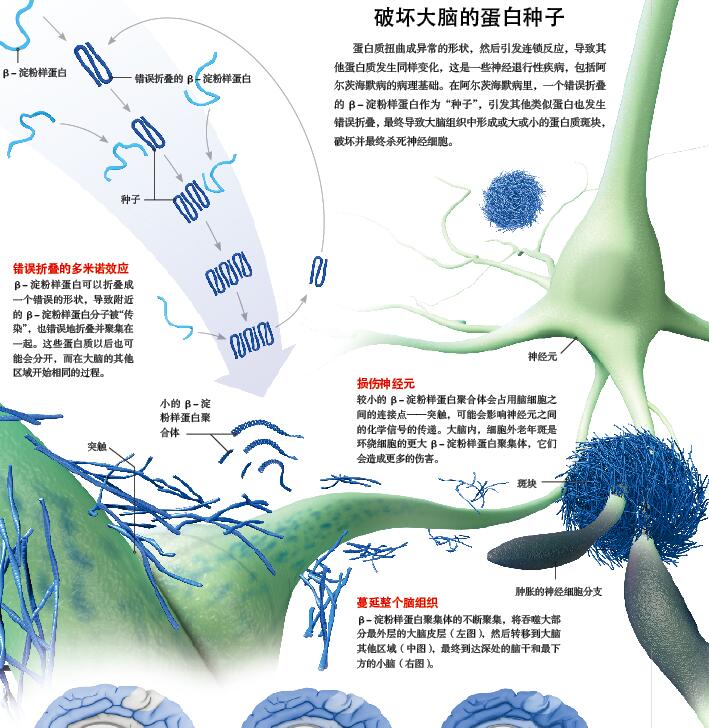
错误折叠的蛋白质
阿尔茨海默病可能与蛋白质的错误折叠有关,这个观点的提出最早可追溯到20世纪60年代。当时,探索朊病毒病的科学家开始注意到,其他神经退行性疾病,尤其是阿尔茨海默病患者中,大脑发生了相似的病变。阿尔茨海默病是造成老年痴呆的最常见原因,常见于高龄人群,发病隐匿,在多年的疾病过程中无情地剥夺患者的记忆、人格,直至生命。在65岁之后,阿尔茨海默病的患病率每5年就会翻一番,到了85岁,每3人就有1人患病。
研究人员也早已发现,蛋白质的病理性沉积参与了阿尔茨海默病的疾病进程。这一疾病以精神病学医生阿洛伊斯·阿尔茨海默(Alois Alzheimer)的名字命名。他在1906年将痴呆症与大脑中的两种特殊病变联系起来:一是细胞外老年斑(Senile plaques,现在我们已经知道,这是由错误折叠的β-淀粉样蛋白沉积而成),二是细胞内的神经元纤维缠结(由过度磷酸化的tau蛋白聚集而成)。在电子显微镜的高倍放大下,可以看到由β-淀粉样蛋白或者tau蛋白聚集形成的长纤维。此外,这些蛋白质的较小聚合物也会严重干扰神经元的正常生理功能。
20世纪60年代,盖杜谢克的团队开始着手检验阿尔茨海默病是否像羊搔痒症、库鲁病和克雅氏病一样具有传染性。研究者从阿尔茨海默病患者中提取脑组织,经过处理后注入灵长类动物大脑。此后,在英国哈罗临床研究中心(Clinical Research Center)的罗莎琳德·雷德利(Rosalind Ridley)和哈里·贝克(Harry Baker)领导的研究团队,也分别独立进行了类似实验。盖杜谢克的实验结果并不确定,两个独立的研究团队也都没能在动物身上完全诱发阿尔茨海默病。不过,英国的研究人员还是有一些小进展,即在至少5年的疾病潜伏期之后,相较于对照组,注入阿尔茨海默病患者病变脑组织的绒猴,大脑中β-淀粉样蛋白斑块明显增多。
当时,我们的研究团队也准备研究错误折叠的β-淀粉样蛋白是否可以作为“种子”,引发级联反应,诱导蛋白的错误折叠和聚集斑块的形成,最终形成遍布阿尔茨海默病患者大脑的蛋白质斑块。但由于发现在猴子中需要5年左右才能诱导斑块形成,我们的计划也停滞了。
20世纪90年代中期,由于阿尔茨海默病转基因小鼠模型的出现,我们适时地改变了实验策略。研究人员将一种灵长类动物基因重组到小鼠体内,这种基因使人体能够产生淀粉样前体蛋白(amyloid precursor protein,APP),它们是β-淀粉样蛋白片段的前体。这样,这种转基因小鼠就可以产生APP和β-淀粉样蛋白。在一批优秀同事和学生的共同努力下,我们设计了一系列实验,试图在小鼠身上证实β-淀粉样蛋白的“种子传播机制”。虽然阿尔茨海默病似乎是人类独有的,转基因动物的表型与阿尔茨海默病患者的病征并不完全相同,但这还是给我们的研究提供了无法比拟的优势:转基因小鼠体型小,易管理,生命期短,并且每只转基因小鼠在脑内自发产生β-淀粉样蛋白斑块时的年龄较固定。
虽然脑内的淀粉样蛋白斑块和神经纤维缠结都可以引起神经退行性病变,从而导致阿尔茨海默病,但我们选择β-淀粉样蛋白而非tau蛋白作为研究重点,是因为现有的大多数研究都显示,错误折叠的β-淀粉样蛋白是推进阿尔茨海默病发病进程的主要因素。实际上,许多阿尔茨海默病的危险因素都与细胞中β-淀粉样蛋白的产生、折叠、聚集和清除过程相关。而导致阿尔茨海默病在早期发病的一些基因突变,都与β-淀粉样蛋白的前体蛋白APP或是APP剪切酶相关(见《环球科学》2006年第6期《叫停阿尔茨海默病》)。并且,研究人员也已知道,在疾病症状出现的十年或更早之前,大脑就开始显现出一些阿尔茨海默病的迹象,例如在疾病发生的极早期就会产生非正常的蛋白聚集(参见《环球科学》2010年第7期《预防阿尔茨海默病》)。知道了错误折叠的β-淀粉样蛋白的堆积对阿尔茨海默病的发生至关重要之后,我们接下来就要探明,究竟是什么因素,首先在大脑里引起了蛋白质的非正常聚集。
在最开始的实验中,我们希望弄清楚,阿尔茨海默病死亡患者的大脑提取物,能否在前述转基因小鼠的大脑中引起β-淀粉样蛋白聚集。换而言之,我们能否诱导并传播β-淀粉样蛋白的聚集,就像朊病毒在海绵状脑病(spongiform encephalopathies)中触发PrP聚集那样的过程?利用朊病毒研究的类似方法,我们先从死于阿尔茨海默病,以及死于其他原因的对照组病人的大脑中,提取了少量组织样品,接着去除大一些的组织碎片,然后把极少量的提取物注入年幼的转基因小鼠的大脑中。
结果证实了我们的想法。在3~5个月之后,也就是在通常情况下,转基因小鼠开始正常产生β-淀粉样蛋白斑块之前,注射了大脑提取物的小鼠的大脑中,就开始出现大量的β-淀粉样蛋白聚集物。而且,β-淀粉样蛋白斑块的产生数量,与大脑提取物中β-淀粉样蛋白的数量,以及注射后的时间呈正比——这是我们希望看到的结果。最重要的是,如果大脑提取物来自对照组,由于其中不含β-淀粉样蛋白,则无法使转基因小鼠的大脑产生β-淀粉样蛋白斑块。
确定病症种子
尽管这些实验数据表明,阿尔茨海默病患者的大脑提取物可以使β-淀粉样蛋白在小鼠大脑中沉积,然而并没有确凿证据显示,大脑提取物中的β-淀粉样蛋白是导致小鼠大脑中β-淀粉样蛋白斑块生成的罪魁祸首。这种不确定性使我们进一步提出了以下几个问题。首先,在小鼠模型中观察到的β-淀粉样蛋白沉积,是否只是我们此前注射进去的大脑提取物?答案是否定的,因为注射一个星期后,没有任何证据表明β-淀粉样蛋白在大脑中发生聚集;而在一个月或更长时间后,斑块才变得明显起来。
其次,我们考虑到,在患者的大脑提取物中,可能是β-淀粉样蛋白之外的其他物质刺激了斑块的形成,比如某种人类病毒。但紧接着,我们便通过实验排除了这一可能性。实验证明,只要含有足够多的β-淀粉样蛋白聚集体,和病人脑提取物一样,无病原体感染的老年APP转基因小鼠的脑提取物也可以有效地诱导β-淀粉样蛋白斑块的形成。此外,因为非阿尔茨海默病患者的大脑提取物并不能引起β-淀粉样蛋白聚集,我们也可以排除斑块的形成是在注射大脑提取物的过程中发生的,也就是说,斑块的形成并不是人体对大脑损伤的一种反应。
尽管现有证据已经明显表明,β-淀粉样蛋白就是斑块形成的元凶,我们仍然希望找出更为直接的证据。我们的第三个步骤就是,使用β-淀粉样蛋白的抗体,特异性地清除了大脑提取物中的β-淀粉样蛋白,而经过这一简单步骤的处理,阿尔茨海默病患者的大脑提取物就无法诱导斑块的形成了。最后,当我们利用强酸,破坏大脑提取物中β-淀粉样蛋白的结构后,大脑提取物也无法诱导斑块形成了。我们因此可以断定,β-淀粉样蛋白的结构形态直接决定了,它们能否诱导其他β-淀粉样蛋白分子发生错误折叠和聚集。
现在,我们有理由确定,在大脑的组织样本中,错误折叠的β-淀粉样蛋白是诱导斑块形成的活性种子,但其中起关键作用的部分还不是很清楚。如果聚集后的β-淀粉样蛋白是种子的话,那么即使没有大脑提取物中的其他分子,我们利用人工合成的β-淀粉样蛋白,让它们在试管中聚集后,也能使大脑产生β-淀粉样蛋白斑块。我们知道,利用合成蛋白作为种子进行实验是一个巨大的挑战,因为在研究朊病毒时科学家就发现,合成物质和大脑的直接提取物虽然只有微妙的差异,但这种差异对它们的效用却至关重要。
带着上述想法,我们将各种形式的、聚集在一起的、人工合成的β-淀粉样蛋白,直接注射到转基因小鼠的大脑中。在等待了3至5个月(通常的潜伏期)之后,结果令人失望,小鼠大脑中并没有明显的斑块形成的迹象。但是最近,普鲁辛纳与加利福尼亚大学旧金山分校的简·斯图(Jan Stöhr)、库尔特·贾尔斯(Kurt Giles),以及他们的合作者,将合成的β-淀粉样蛋白注射到转基因小鼠大脑,并把观察时间延长到6个月之后,他们在小鼠的大脑中成功观察到了β-淀粉样蛋白聚集的现象。虽然人工合成的β-淀粉样蛋白效果要比天然的差一些,但这个结果提供了强有力的证据,表明在没有其他因素的情况下,合成的β-淀粉样蛋白自身即可在大脑中诱导形成蛋白斑块。
在最近的研究中,我们开始进一步探究,β-淀粉样蛋白的哪些特性,会使得大脑中的蛋白发生聚集。由于大多数β-淀粉样蛋白都存在于大脑提取物里不可溶的长纤维中,我们推测,这些纤维就是最有效的种子。但结果令我们吃惊。通过对富含β-淀粉样蛋白的大脑提取物进行分离,我们得到了两种组分,一种是含有大量β-淀粉样蛋白的不可溶纤维沉淀,一种是沉淀上层含少量可溶性β-淀粉样蛋白的上清液。我们将不可溶的纤维沉淀打碎,注射到转基因小鼠的大脑中后,结果发现纤维沉淀和大脑提取物一样,都能导致纤维沉淀聚集。然而出乎意料的是,尽管上清液中,β-淀粉样蛋白的含量不到沉淀部分的千分之一,它也能有效导致β-淀粉样蛋白的聚集和斑块的形成。此外,我们还发现,上清液中可溶的β-淀粉样蛋白非常容易被蛋白酶K降解,而纤维沉淀中不可溶的却不会被降解。
“可溶的种子”,既是个坏消息,也是个好消息。坏消息是,比起不可溶的纤维,这类β-淀粉样蛋白容易进入大脑,会是格外有效的种子;但好消息是,它们对蛋白酶K敏感,很容易被针对性的治疗手段清除。另外,因为它们可溶,因而容易在体液中被检测出来,从而可以作为阿尔茨海默病早期诊断的一个标志。但由于“播种”过程发生在疾病的极早期阶段,要找到行之有效的检测手段并消除这些有害种子,以防止大脑损伤和痴呆的产生,还有很长的一段路要走。
阿尔茨海默病之外
自然界总是会尽可能地物尽其用,同样的机制也会尽可能地应用于多种途径,这类“种子式”的扩散机制也不例外。科学家发现,该机制除了在疾病的发生中至关重要,还具有一些有益的作用。例如,美国国立卫生研究院的里德·维克纳(Reed Wickner)在1990年提出,一些真菌蛋白可能通过这种机制来维持生存,而现在,这一观点已经被很多实验室证明。另外,麻省理工大学的苏珊·林奎斯特(Susan Lindquist)和哥伦比亚大学的埃里克·R·坎德尔(Eric R. Kandel)还提出了一个有趣的假说:某些蛋白可通过类似朊病毒的传播途径,稳定大脑神经回路,促进长期记忆的形成。
然而到目前为止,蛋白种子的聚集,大多数情况下都指向疾病发生,包括在帕金森症中起作用的α-核突触蛋白(α-synuclein)、在脊髓侧索硬化症中起作用的超氧化物歧化酶-1(superoxide dismutase-1)、在肌萎缩和额颞叶痴呆中起作用的TDP-43蛋白、在亨廷顿舞蹈症中起作用的亨廷顿蛋白(huntingtin)以及在多种神经退行性疾病中起作用的tau蛋白。此外,科学家还发现,在很多其他神经退行性疾病中也存在蛋白的传染扩散现象。因此,明确蛋白种子机制是否是造成这种现象的原因,对这些疾病的研究至关重要。
在新的研究中,科学家发现,许多具有基因调控功能的蛋白质,都含有与朊病毒相似的结构域,这个结构域由一系列氨基酸组成,使该蛋白能够诱导同类蛋白形成相同的蛋白结构。而且,这些蛋白质往往有聚集的倾向,而且某些突变还可以增强这种倾向。由美国孟菲斯圣犹大儿童研究医院的J·保罗·泰勒(J. Paul Taylor)和宾夕法尼亚大学的詹姆斯·肖特(James Shorter)共同领导的研究团队报道称,在核酸结合蛋白hnRNPA2B1和hnRNPA1中,类似朊病毒的结构域发生突变,可引起多系统蛋白病(multisystem proteinopathy),这是一类可影响神经系统、肌肉和骨骼的复杂疾病。此外,实验证明,“种子机制”也存在于神经系统之外的其他疾病中,如某些淀粉样变性。随着研究的深入,研究人员可能还会发现有更多疾病与“种子机制”有关。
我们已经逐渐认识了这种蛋白传染机制,如果要针对这种机制来设计疾病治疗方案,首先我们必须知道,错误折叠的蛋白质是如何损伤细胞和组织的。尽管阻断有害蛋白的聚集有一定难度,但这些信息至少可以帮助我们控制有害蛋白对细胞和组织的损伤。研究表明,蛋白聚集可从多方面损害细胞的功能——从与细胞组分间的有害相互作用,到阻止功能正常的蛋白抵达它们发挥功能的位点,不一而足。同时,我们必须更好地理解这些有害蛋白是怎样形成和降解的,并且需要了解它们在什么情况下会发生错误折叠,并形成传染性种子。对疾病发生的深入研究,还需要阐明细胞内的这种传染性种子是如何被运载、传送并释放的。最后一个重要问题是,为什么随着人的年龄增高,患神经退行性疾病的风险会升高。这些问题的答案将会为抑制有害蛋白的传播指明方向。
大量确凿的证据已经逐步证明前所提到的观点,即简单的结构改变就可将一个蛋白从“朋友”变成“敌人”。普鲁辛纳在诺贝尔获奖颁奖典礼上讲述朊病毒的发现时曾预言,朊病毒将自身的毒性特性强加并传递给其他正常蛋白,从而引发疯牛病和相关疾病的机制,也可以用来阐释其他退行性疾病。过去十年,研究人员在实验上证实了普鲁辛纳的预言。类似朊病毒的蛋白种子的聚集,也许的确可以解释某些可怕的老年疾病的成因——也为人们提供了一个引人注目的路标。也许有一天,我们可以通过抑制种子蛋白的聚集,阻断神经退行性疾病的无情蔓延。
本文译者:
李艳芳是厦门大学医学院助理教授,主要研究老年性痴呆症的细胞与分子病理机制,尤其是老年痴呆症相关蛋白在神经元突触可塑性及学习记忆中的重要作用。
张弦是厦门大学医学院助理教授,研究方向是老年性痴呆症的发病机制。
张云武是厦门大学神经科学研究所教授,主要从事阿尔茨海默病的细胞与分子病理机制研究。
许华曦是厦门大学神经科学研究所教授,主要研究领域为分子和细胞神经生物学,特别是在研究阿尔茨海默病发病机理方面,涉及遗传学、神经生物学、细胞和分子生物学等多个专业领域。
请 登录 发表评论