定做一个蛋白质
撰文 克里斯蒂安·E·沙夫迈斯特(Christian E. Schafmeister)
翻译 张睿
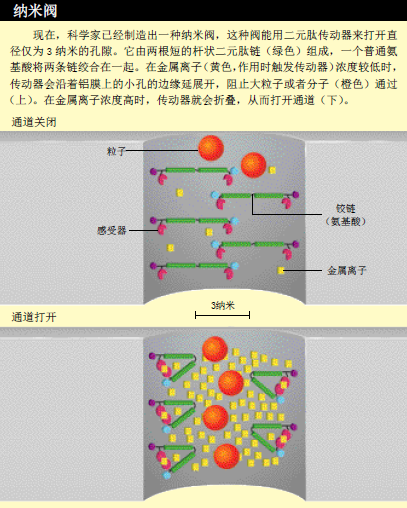
很多科学家都在为制造纳米装置而绞尽脑汁,在这方面,蛋白质给他们上了生动的一课。作为生物体内的“纳米机器”,蛋白质是一种包含了上万个原子的大分子,它的大小一般在几纳米到几十纳米(1纳米等于10-9米)。在我们的身体内,至少有两万种不同的蛋白质,它们能促进肌肉收缩、消化食物、建造骨骼、感测环境,不知疲倦地让成百上千的小分子在我们的细胞里循环。
1986年,我还是个化学专业的大学生。那时的我,就梦想着有朝一日能够亲自设计和合成具有强大功能的大分子,让它完成蛋白质无法完成的任务。但是如何才能实现这个梦想呢?我想到了计算机。自从20世纪70年代末,第一台TRS-80s(早期的微型电脑)诞生以来,我就在编写计算机程序。如果建造复杂的分子装置能像编写软件那样简便的话,该有多么美妙。我梦想着编写一套“物质程序语言”(programming language for matter),把软件知识和化学知识结合起来,让人们用软件设计出化学工艺,化学家或机器只须按部就班地执行,就能成功制造出纳米机器。
不幸的是,通过设计新的蛋白质来创造纳米装置的构想,遇到了巨大的障碍。蛋白质由一条或数条氨基酸链组成,氨基酸链又包含了多种氨基酸(世界上共有20种氨基酸)。当氨基酸链在细胞中装配完毕,很快便通过一个非常复杂的过程,把自己折叠成更为高级的结构。氨基酸的序列决定了蛋白质的最终结构,从而决定了蛋白质的性质和功能,因此预测一个独特的序列会折叠成什么形状,成了工程学中具有重大意义的研究项目,但这个“蛋白质折叠问题”却让很多科学家铩羽而归。
在提出最初构想整整20年后,我的实验室才找到了一种方法,可以按照预先设计的形状来制造大分子,同时还开发出了用于设计分子形状的计算机软件。这种实验方法的灵感,来自天然蛋白质的模块化特性。这种模块化不依赖氨基酸链自发折叠而成的某种形状,所以这种方法避开了几乎无法逾越的蛋白质折叠问题。
我们正在逐步完善这项技术,希望用它来制造执行特殊功能的分子。最初制定的一个目标,就是制造能够充当传感器的大分子:当它与毒素之类的目标分子结合时,传感器分子的两个荧光基团就会接触在一起,传感器的颜色立即发生改变,指示在样品中存在检测目标。我们用这项技术制造出了较长的铰链分子,它能根据外部信号而开合,从而为制造分子传动器、分子阀和计算机存储器奠定了基础。
我们预计,以此技术为基础,将会诞生更多更先进的纳米装置制造方法。利用这些方法,可以制造复杂的纳米工具,例如类似于核糖体(细胞内组装蛋白质的细胞器)的装配机器,能在外部程序的控制下,组装其他纳米机器。
绕开折叠难题
天然蛋白质会自我折叠,形成高级结构。折叠过程非常复杂,难以模拟,可是人造蛋白又必须拥有高级结构才能发挥功能,怎么办呢?科学家想到了一个极端的办法:绕过折叠过程!
1990年,我刚刚大学毕业。当时我认为,开发纳米装置的关键,应该是推导出蛋白质的折叠规则,然后在这些规则的指导下,制造出新的蛋白质。随后,我来到美国加利福尼亚大学旧金山分校,加盟了罗伯特·M·斯特劳德(Robert M.Stroud)的蛋白质结晶学研究小组。蛋白质结晶学的研究方法,主要是培育蛋白质晶体,再用X射线来准确测定蛋白质的三维结构。借助这项技术,我对蛋白质那美丽而复杂的结构有了更深刻的认识。在这个研究小组的4年时间里,我都醉心于制造一个自己设计的人造蛋白质——4HB1。我先合成了一个人造基因,把它插入到细菌中,细菌便会利用这个基因合成蛋白质。得到细菌合成的蛋白质后,让这个蛋白质结晶,并用X射线测定它的晶体结构。最后的发现令我激动万分:4HB1的构造恰好与我的设计一模一样!
然而,我的兴奋并没有持续多久,4HB1虽然是一个折叠完整的人工蛋白质,但没有任何功能。最让人沮丧的是,我在研究中没能找出蛋白质折叠的简单规则——换句话说,我想利用折叠规则,按照预先设计的形状来制造蛋白质的梦想泡汤了。相反,蛋白质折叠的复杂性却暗示,“简单”的折叠规则可能根本就不存在。1997年,我获得博士学位,对这项研究也有了更好的想法:预先设计的蛋白质也许可以用一套模块来构建,不需要通过复杂的折叠过程来获得想要的形状。
这并非一个全新的想法。1995年,美国得克萨斯大学奥斯汀分校的布伦特·艾弗森(Brent Iverson)开发了一些构建模块,可以连接在一起,形成短小的聚合体(寡聚体)。寡聚体中富含电子的基团会给缺乏电子的基团提供电子,并不断拉近两种基团之间的距离。在电子的作用下,寡聚体就会自我组装成褶状结构。
几乎同时,美国威斯康星大学麦迪逊分校的萨姆·吉尔曼(Sam Gellman)和瑞士苏黎世联邦理工学院的迪特尔·泽巴赫(Dieter Seebach)合作,合成了一种叫做β-肽的短小分子。这是一种由β-氨基酸组成的柔性链,会折叠成螺旋状结构。β-氨基酸的结构和普通氨基酸(α-氨基酸)只有细微的区别,不过自然界中几乎不存在这种分子。
虽然上述两种方法都能制造特定形状的大分子,在一定程度上绕开了蛋白质折叠问题,但另一个难题出现了:在普通氨基酸组成的天然和人造蛋白中,氨基酸之间一般通过单键连接,这就使得蛋白质的结构有很大的自由性,氨基酸链能在其长度范围内的任意位置弯曲。氨基酸链怎么弯曲、蛋白质最终会有怎样的结构,取决于氨基酸链上的氨基酸相互靠近时,产生的引力和斥力的综合作用。正是由于这些错综复杂的作用力,才很难预测蛋白质的最终结构。
于是,我想到了一个极端的方法来解决这个问题:绕过所有的蛋白质折叠过程,真正控制人工蛋白质的最终结构。为了将想法变为现实,我开始制造结构不易发生变化的构建单元,单元之间能通过一对化学键相连,这样就能“拼装”出结构稳固的梯状大分子。其实早在1987年,就有人尝试过这个想法。当时,英国谢菲尔德大学的弗雷泽·斯托达特(Fraser Stoddart)提出了“分子模块”的概念,利用构建单元来拼装“分子带”和“分子圈”。
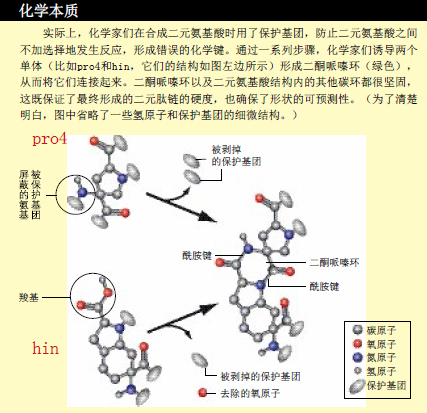
后来,我又进入了美国哈佛大学格里戈里·韦尔汀(Gregory Verdine)的实验室,学习合成有机化学。我在那里呆了两年,一直在合成自然界中原本不存在的氨基酸,不断寻找通往我远大理想的道路。一次偶然的机会,我看到一篇论文,描述了一种名叫二酮哌嗪的化学结构。在该结构中,6个原子连接成含有两条酰胺键的环。氨基酸就是通过酰胺键连接成氨基酸链的,就像人们手拉手排成一行一样。当两个氨基酸结合到一起,一个二酮哌嗪就形成了,如同两个人面对面,两双手臂拉在一起,形成一个闭合的环。研究合成蛋白的化学家已经发明了很多反应方法,能在氨基酸之间形成酰胺键。但酰胺键经常在不需要的时候出现,让化学家的努力付诸东流。然而我却认为,也许二酮哌嗪能将我的构建单元连接起来。
很快,我的整个思路便成形了。如果把氨基酸比作“人”,氨基酸的两个基团(氨基和羧基)就像是人的两条“手臂”。设想一下,其中一个是左臂,另一个是右臂,酰胺键就是握在一起的左手和右手。而我制造的每一个构建单元,都像两个手臂前伸、背靠背紧紧站在一起的人。一个单元中的“人”与另一个单元中的“人”双手相连,就能形成一个二酮哌嗪环,从而将两个构建单元稳固地连接起来。
用化学术语来说,每个单元都是一个结构坚固的分子(主要成分是碳原子),由两个氨基酸组成,每个氨基酸上的氨基和羧基都能结合其他单元。两个单元相遇时,面对面的两个氨基酸上的氨基和羧基就会发生反应,形成一个二酮哌嗪环,将两个单元连接在一起。因为每个单元都含有两个氨基酸,我把这种构建单元叫做二元氨基酸(bis-amino acid,“bis”表示二)。正如普通的氨基酸链被称为肽一样,我们称二元氨基酸链为“二元肽”(bis-peptides,目前尚无统一的中文译名)。
从偶然中开始
科学家利用多种方法,终于合成出了自然界中原本并不存在的二元氨基酸单元。随后,利用这些单元,又拼装出了一条类似于天然肽链的二元肽。科学家惊喜地发现,二元肽的性质很稳定,很可能是一种制造药物的备选材料。
带着制造构建单元的计划,我在美国匹兹堡大学建立了一个实验室,与我的学生一起,利用有机合成的方法,来实现我的分子拼装之梦。克里斯多弗·莱文斯(Christopher Levins)是我带的第一届研究生,他用两年的时间合成出了第一个二元氨基酸。克里斯多佛用的原材料是羟脯氨酸,这是胶原蛋白(强化软骨、韧带和肌键的蛋白质)的组成成分,在销售化学试剂的商店里很容易买到。其他研究小组也曾用羟脯氨酸来制造与我们设计的单元非常相似的分子。莱文斯利用“9步合成法”,将羟脯氨酸转换成了4种构建单元,我们将这些单元分别称作pro4(2S4S)、pro4(2S4R)、pro4(2R4S) 和pro4(2R4R)。“pro4”的含义是,我们在脯氨酸的第4号碳原子上,又“装”上了一个额外的氨基酸(化学家将有机分子中的碳原子系统地标上序号,以便于识别这些碳原子)。“S”和“R”则表示“连接”在2号和4号碳原子上的基团所指的方向。合成好的单元均为干粉状,能在室温下稳定地储存数月之久。
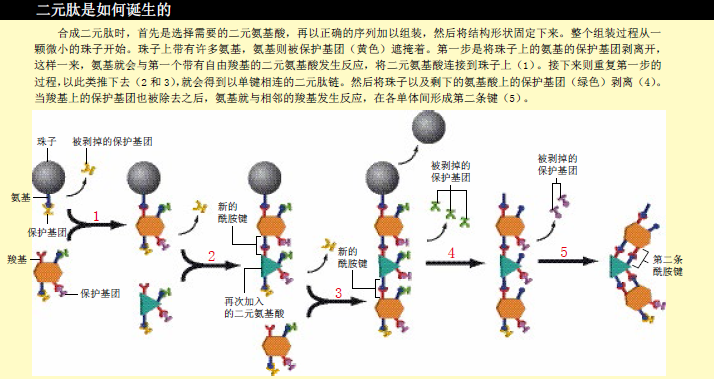
在合成二元肽时,我们采用了两步合成法:根据预先设计的顺序,用单键将构建单元串联起来后,再将所有第二条酰胺键连接起来,使分子的结构固定下来,形成最终结构。在开始制造构建单元之前,我们就在氨基酸的氨基上特意加上了保护基团,还对一个羧基进行了修饰,形成了一个酯,以降低它的反应性,防止酰胺键在不需要的时候出现。莱文斯利用上面的方法,成功地用pro4单元“拼装”出了第一条二元肽。
在两步法的第一个步骤中,我们利用了固相载体合成技术来连接构建单元。在微小的塑料珠子(固相载体)上,我们嵌合了许多氨基,当第一个单元的羧基与珠子上的氨基形成酰胺键时,这个单元就被固定在了塑料珠子上。我们会让大量的构建单元靠近塑料珠,确保珠子上的每一个氨基都会结合一个单元。接下来则是一个快速的洗涤过程,溶剂会将副产物和剩余单元统统带走。我们又用碱溶液将构建单元上两个氨基保护基团中的一个除去(每个单元含有两个氨基酸,因而就有两个氨基,我们给这两个氨基加上了不同的保护基团,所以一种碱溶液只能剥离一个保护基团)。第二个单元的羧基则和第一个单元上裸露的氨基相连。然后再将第二个单元中的氨基保护基团剥离一个。以此类推,再加上第三个单元……
这种拼装过程十分缓慢,每连接一个单元要花费大约一个小时,因为我们必须等待足够长的时间,让所有裸露的氨基都连上了下一个构建单元。值得庆幸的是,常用于合成普通肽链的自动合成仪可以自动地完成这些工作,而且一次就能同时制造许多序列。
当一条二元肽链初步连接起来后,我们就“剥离”塑料珠子、去除链上每个单元的第二个氨基保护基团。最后加入碱溶液,让每个单元上新暴露出来的氨基与它前面的酯发生反应,形成第二条酰胺键。这样一来,相邻单元都由两条酰胺键相连接,整个分子的结构就被固定下来。
我们很快发现二元肽可溶于水和其他的极性有机溶剂(易溶于水的有机溶剂)。水溶性使得科学家对二元肽的研究变得更加容易,这也意味着,如果要开发一种必须在血液中迅速溶解和扩散的新药物,二元肽绝对是一种很好的备选材料。
设计形状
科学家编写了一套计算机软件,用于设计人造蛋白质的形状。但在制备过程中,他们又遇到了新难题:在不同单元之间,酰胺键形成的速度不一,如果单纯提高反应温度,人造蛋白的结构就会混乱不堪。如何才能解决这一难题呢?
二元氨基酸就像造型奇异的积木:顶部倾斜,整体构型扭曲。如果将多个同一类型的二元氨基酸连接在一起,就能得到一条弯曲的二元肽。至于弯曲成什么形状,取决于选择的二元氨基酸的种类。将两种不同的二元氨基酸连接起来,就能得到2N种不同形状的二元肽(N是链上的单元数)。假如以我们制造的那4种pro4二元氨基酸为材料,来构建长为10个单元的二元肽,就能得到上百万(410)种形状不一的二元肽。我们拥有的单元的形状越多,就越容易控制大分子最终的结构。接下来的挑战便是,设计和合成具备某些功能的序列。
设计具有特殊形状的二元肽的关键在于,我们需要清楚地知道,当一个二元氨基酸与另一个相连接时,它所呈现出的精确形状,比如它的尺寸、顶部的倾斜度以及整个单元的扭曲度,这些信息就是“物质程序语言”的基础。因此,当第一条二元肽合成完毕之后,我们就立即展开了检测工作,确定链上各个单元之间的具体连接方式。
我们运用核磁共振技术,找出二元肽上相邻的氢原子;使用其他技术,测定碳氢键的取向。根据测定的结果,我们推断出构造信息,再利用这些信息,开发出了计算机辅助设计程序CANDO(纳米结构的计算机辅助设计和优化),用于设计和制造二元肽。
格里戈里·伯德(Gregory Bird)也是我们实验室的研究生,他用CANDO设计了一些杆状分子和弯曲的结构。最近,他组装了这些结构,把一种名叫“自旋探针”的化学基团连接到每条二元肽的末端,以便观察合成结果是否与计算机设计的形状一致。观察结果正如CANDO所预测的一样,利用pro4(2S4S)和pro4(2R4R)两种单元连接而成的序列,确实拥有相应的C形和S形。
在二元氨基酸中,pro4基团的倾斜度相对较小,所以我们能用它们来制造类似于杆状而又轻微弯曲的形状。这种形状能起支柱的作用,让化学基团之间保持一定的距离。然而,蛋白质之所以具有很多有用的功能,却是因为分子内部拥有一些空腔,能将蛋白质结合到目的分子上,或者容纳一些分子,催化生物化学反应。要制造结构紧凑、带有适当空腔的二元肽,我们还需要对“材料库”进行扩容。我的学生斯蒂芬·哈贝(Stephen Habay)向这个目标迈出了第一步——他开发了一个名为“hin”的二元氨基酸,这成了二元肽制造史上的一个巨大转折点。
几年过去了,我们收集的构建单元越来越多。CANDO分析显示,利用我们现有的14个单元,就足以制造结构紧凑、拥有空腔的二元肽。不过在开发新的构建单元,并将它们拼装成二元肽的过程中,我们又遇到了新的麻烦。前面提到过,为了把分子结构固定下来,需要在每个单元之间形成第二条酰胺键。在pro4单体之间,这个反应非常迅速,而在我们新开发出来的构建单元之间,这一反应过程却进行得相当缓慢。提高反应温度虽能加快反应速度,但这样只能得到构型混乱的二元肽。这个问题成了一个巨大的障碍,若不跨过这个障碍,就很难制造出大而复杂的二元肽。
我的学生沙拉德·古普塔(Sharad Gupta)在一定程度上解决了这个难题。他发明了一个新的方法来促使第二条酰胺键的形成:改变每个单体上的酯的状态,让它易于与氨基反应。古普塔还从一篇于20世纪70年代发表的论文上得到了灵感,用乙酸代替碱作为催化剂。用乙酸作为催化剂,在加热提高反应速度时,就不会再像用碱那样,使二元肽的形状出现混乱。
我们用了6个月时间来寻找最佳反应条件,包括要使用的酯、保护基团、溶剂和温度,但仍未彻底解决这个问题,一旦二元肽序列的长度超过5个单元,这个方案就会失效。因此,我们目前能够高效制造的二元肽,仅限于pro4单元构成的分子,或其他单元构成的长度不足5个单元的分子。尽管如此,我们仍在集中精力,利用这些二元肽开发一些应用项目。
开发应用项目
现在,科学家们已经开始利用二元肽制造一些有用的纳米装置,比如可以自动释放药物为病人治病的分子传动器、能够合成“天价”药物的人工酶等,他们甚至还想制造能够自动合成人造蛋白的人造蛋白!

能够紧密结合霍乱毒素蛋白(Ctx)的二元肽大分子,是我们最想实现的应用项目。毒素蛋白呈五角形,每个角上都有一个相同的“口袋”。 GM1糖分子刚好可以装进口袋中,这样霍乱毒素蛋白就能与GM1糖分子结合。在小肠上皮细胞表面,有许多GM1分子。当霍乱毒素蛋白与5个GM1分子结合时,就会启动毒素反应,导致致命的剧烈腹泻。如果能找到一种大分子,让它与霍乱毒素蛋白的口袋紧密结合,就能阻止毒素结合在人体细胞上,从而预防疾病。
一些研究人员已开发出一些较小的糖分子,能与毒素蛋白上的口袋结合。但是糖分子的药效不佳,因为它与霍乱毒素蛋白的结合不够牢靠,而且一次只能与一个口袋结合。相比之下,人体细胞上的GM1能够与霍乱毒素蛋白的5个口袋同时发生作用,力量显然强大得多。如果能够合成一种二元肽,在它的两个末端都配上糖分子,而且二元肽的长度刚好等于霍乱毒素蛋白上相邻两个口袋的间距,这样也许能阻止毒素与细胞结合。结果实验奏效了,附着了两个糖分子的二元肽与霍乱毒素蛋白结合得更紧密,结合效果几乎可以和天然GM1分子相媲美。
不过,我们还不能肯定,这些二元肽是结合在一个霍乱毒素蛋白的两个口袋上,还是恰好结合在两个不同毒素蛋白的口袋上,把毒素蛋白交织成一个网络。如果是后面一种情况,那么这种二元肽就无法有效治疗霍乱,因为只有当人体内已经积累了大量霍乱毒素蛋白(有可能是致命剂量)时,这种结合方式才会发挥作用(如果霍乱毒素蛋白的浓度很低,那么一条二元肽同时与两个霍乱毒素蛋白的口袋结合的几率就非常小)。不过,在病毒的表面形成交联蛋白,就能有效抑制病毒活性,我们正在使用这种方法来抑制艾滋病病毒、埃博拉病毒等各种病毒。
我们还在坚固的杆状分子两端添加了化学基团,再把两个分子连接起来,做成了一个分子传动器,它会根据外部信号作出反应。我们设计的分子传动器通常处于打开状态,当分子末端与金属离子或小分子结合时,传动器就会折叠或闭合。我的学生劳拉·贝拉斯科(Laura Velasco)制作出了第一个分子传动器。在他的传动器中,杆状分子由4个二元氨基酸组成,充当铰链的是一个普通氨基酸,传动器的开或关则由金属离子触发。我们利用贝拉斯科的传动器,制造了一个分子阀。这个分子阀有一个纳米级的孔,在纳米孔的周围,连接有杆状二元肽链。当传动器伸展时,就会把孔堵住;折叠时,纳米孔则处于开放状态。这些分子阀可用于感应病人的病情,在恰当的时候释放药物为病人治病。
如果在杆的末端连上某些化学基团,当某种电荷出现时,化学基团能正确识别并与之结合,那么我们就能电动控制传动器的开启和关闭。如果通过这种方式能单独控制这些传动器,就能用大量的传动器来制造计算机存储装置。传动器的开和关可以代表0或1,这些数据可以通过原子力显微镜探针的逐排扫描而读取出来。
生物体内的蛋白质由20种氨基酸构成,这些氨基酸的侧链上点缀着各种各样的化学基团。与此类似,我的实验室也在开发带有额外化学基团的二元氨基酸单元,用这些单元制造二元肽,化学基团便会沿着二元肽的梯形骨架排列。如果能仿造天然酶“功能中心”(即发挥催化作用的部位)上的化学基团排列顺序,制造出身上“挂着”类似化学基团的大分子,我们也许就能制造出与天然酶一模一样的人工酶。
我可以预言,在今后20年内,分子拼装开发领域将异常活跃:数十个研究小组都会用二元肽制造大分子,不断探索如何生产人工酶和其他价值非凡的“分子机器”。一些抗癌药物,比如大田软海绵素(halichondrin B)和苔藓虫素(bryostatin),现在看来疗效虽然不错,但合成起来却需要极高的成本。生产原材料都是珍稀的海洋生物,根本满足不了药物的生产需求。在20年内,我们也许能制造出人工酶,高效合成目前的“天价药物”,并且不会造成环境危害。想象一下,只要将一滴含有人工酶的溶液加入一大桶玉米糖浆中,几天后就能收获数量惊人的苔藓虫素,那该多么令人兴奋!
如果开发出的人工酶能降解植物纤维素,将它变成乙醇,或者能利用的光能量将水和二氧化碳结合起来,转化为乙醇,整个人类社会都将受益匪浅。我们甚至能设计人工酶来合成二元氨基酸单元,将它们连接起来,这样就能轻松制造二元肽链。
我们已经将化学和软件知识融为一体,可以按照预先设计的形状来生产大分子。我们能在几周的时间内,设计、组装、检测二元肽,迅速开发出新一代产品。在未来的几年,我们面临的挑战是,如何从人工蛋白的功能着手,设计出最佳二元肽序列来执行这些功能。
请 登录 发表评论