试验药物:吃还是不吃?
撰文 贝丽尔·利夫·本德利(Beryl Lieff Benderly)
翻译 王寒明 王怀良
阿比盖尔·伯勒斯(Abigail Burroughs)去世了,年仅21岁。美国人,甚至全球人民的医疗方式,都可能因她的去世而改变。
伯勒斯身患癌症,现有药物都无法挽救她的生命。主治医生向她推荐了一些尚处于研究阶段的药物,认为它们有可能抑制癌细胞。但政府法规却掐灭了伯勒斯生的希望:法规明确规定,病人不能使用试验药物。最后,亲友们只能眼睁睁看着她生命的消逝。
伯勒斯去世后,“阿比盖尔联盟”随即成立。这个联盟希望借助法律手段,让病人获得使用试验药物的权利。联盟还向法院提起诉讼,状告政府法规侵犯了伯勒斯捍卫生命的权利。2007年8月,美国哥伦比亚地区法院驳回了诉讼请求,但联盟成员并不甘心,他们打算向美国最高法院上诉。
不管法院最终如何判决,这一案件都对医药卫生领域产生了深远影响。从艾滋病横行开始,治愈患者与新药审批法规的矛盾就不断加剧,“阿比盖尔事件”则成为一根导火索,使矛盾彻底激化。一方面,绝症患者渴望尽快使用试验药物,获得生机;另一方面,科学家坚守已建立数十年的“黄金准则”——一种新药问世之前,必须经过一系列临床试验的验证,但这个过程要花费近十年的时间。虽然双方都是以挽救病人生命为目的,但策略选择上却背道而驰。
管理药物销售和新药临床试验的美国食品及药品管理局(FDA),是阿比盖尔事件的另一个主角。任何新药,只有通过了安全性与有效性验证,FDA才会允许它上市销售。多年来,FDA的处境一直很尴尬:人们不断要求加快药物审批速度,可是一旦药品出现安全问题,人们又会指责FDA的审批过程不够谨慎。
对于“阿比盖尔事件”, FDA虽然没有公开表态,但有一点已经很明显:如果阿比盖尔联盟胜诉,药物使用权限肯定会扩大,那些安全性和有效性没有经过充分验证的药物将提前走出实验室。临床试验协会认为,已有45年历史的药物临床试验系统也许会因这一改变而瘫痪。临床试验的条件非常严格,如果病人没有参加试验,却能使用试验药物,将在无意中干扰临床试验,而决定药物安全与有效性的最可信方法也将形同虚设。
很多病人都相信,临床试验有助于疾病治疗,是一个恢复健康的绝佳机会,并“奋不顾身”地参与试验。但试验目的与病人的期望相去甚远。开展临床试验只是为了回答一个科学问题:试验药物到底安不安全,有没有疗效?而不是为病人治病。在临床试验开始之前,研究人员会告诉病人试验目的,还要向他们解释试验药物的有效统计结果不是完全可信,存在潜在风险等问题。然而对健康的渴望,让病人们顾不上这些。调查表明,大部分受试者都产生了生物伦理学家所说的“治疗错觉”,甚至很多医生都会误解病人对试验的期望。美国马里兰大学生物伦理学与生物化学家阿迪尔·沙穆(Adil Shamoo)说,参加临床试验就像“去拉斯韦加斯,每个人都认为他将在那里大捞一笔”,但大部分人都输得一塌糊涂。
新药上市之前
为了保证药物的安全性和有效性,所有新药在上市之前,都将经历一次又一次的试验验证。一种新药从研发到临床试验,再到上市销售,至少需要八九年时间。
保护病人免受药物危害是现代临床试验系统的基本要求。这个系统的雏形,可追溯到60年前。1938年,因服用含有二甘醇的抗感染药物磺胺制剂(Elixir Sulfanilamide),107人死于非命。这一事件催生了美国最初的药品法规,即《食品、药品与化妆品法案》。法案要求新药上市之前,必须经过安全性验证。1962年,又因为一次惨痛的教训,FDA对《食品、药品与化妆品法案》进行修正,增加了一条法规——新药上市之前还必须验证它的有效性。
反应停(thalidomide)可治疗失眠和妊娠呕吐、恶心等病症,曾在世界范围内广泛使用。但它一直未能进入美国市场,因为FDA在审查制药商提交的试验数据时,对反应停的安全性产生了怀疑,便拒绝了上市申请。FDA的怀疑很快就得到了印证:孕妇服用反应停会导致新生儿严重畸形,在1961年出生的胎儿中,竟有1万多名是畸形儿!这是一场席卷全球的灾难,只有美国因为FDA的正确判断而幸免于难。25年后,由于艾滋病的出现,FDA允许身患绝症而又无药可治的病人,在特定环境下冒险使用试验药物,因为这些病人随时可能死亡,使用试验药物利大于弊。不过,美国法律并不认可这种行为。
一种新药从研发到临床试验,再到上市销售,一般需要8~9年时间。但花了时间,付出了努力,并不代表就能成功。据FDA统计,只有很少一部分新药最终能通过审批。从美国药物研究制造协会提供的数据中,更能看出药物开发的艰难:5000种候选药物中,能进入临床试验的,可能只有5种,而在这5种当中,很可能只有1种最终能进入市场。临床试验中,检验药物的“黄金准则”是双盲对照试验。试验中,受试者必须同意随机分配,要么进入试验组(服用试验药物),要么是对照组(服用安慰剂或其他药物)。但受试者和临床医生都不能知道分组情况。
临床试验分三期。Ⅰ期试验通常需要20位~80位健康自愿者。在涉及高毒物质(如抗癌药物)的情况下,受试者通常是无药可治的病人。这一阶段的试验主要是了解药物的安全剂量、副作用、对机体代谢的影响以及作用机制等,偶尔也会得到证明药物有效性的证据。如果药物表现出极高的安全性(这时,安全性没有完全确定),就进入下一期临床试验。
Ⅱ期试验需要数百名患有相应疾病的患者,研究人员要找到药物有效性、风险度以及短期副作用等方面的证据。如果试验结果令人满意,Ⅲ期临床将再次增加受试者人数(一般需要数千名病人)。研究人员仍然会对比试验药物和对照药物,以便得到更多的有关有效性和安全性的数据。FDA将以这些数据为基础,判断是否批准该药上市。
逝去的生命
因为法规的限制,也因为某些制药公司的“吝啬”,不少重病患者得不到可以救命的试验药物,等待他们的,就只有死亡。
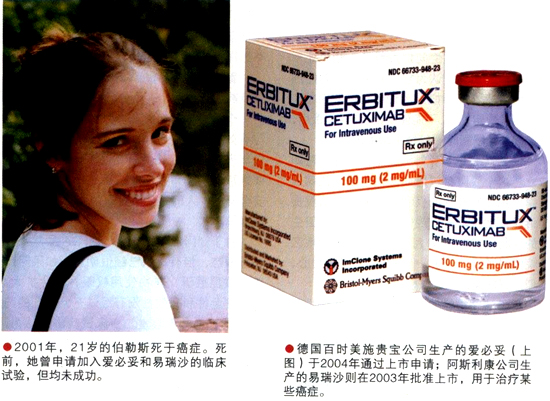
目前,美国的相关法规允许一些重病患者在别无他法,而又没有参与临床试验的情况下,使用已通过Ⅱ期临床试验的药物。但在伯勒斯活着的最后几个月里,她却没能享受到这样的待遇。医生认为,在伯勒斯的肿瘤内,存在着大量的表皮生长因子受体,如果使用爱必妥(西妥昔单抗)和易瑞沙(吉非替尼)阻断这些受体,也许就能治疗她的头颈部鳞状上皮细胞癌。但在当时,这两种药都没有通过审批,伯勒斯与生存的机会失之交臂。对此,她的父亲弗兰克·伯勒斯(Frank Burroughs)非常愤怒,伯勒斯去世不久,弗兰克就在2001年11月创建了阿比盖尔联盟。
在进行临床试验之前,申请者必须提交以前的试验数据,证明候选药物可能是安全有效的。在招募受试者时,必须挑选伯勒斯这样身患绝症而又无药可治的病人。参加临床试验,受试者就得到了使用试验药物的机会,但效果则取决于试验阶段和试验设计。试验申请者会为受试者提供免费药物,但他们没有义务向试验之外的其他病人提供任何药物。
斯科特·戈特利布(Scott Gottlieb)曾任FDA医学和科学事务部副主任(现为私人医生,并在美国企业家协会任职),他认为,阿比盖尔联盟即使打赢了官司,试验药物的使用仍会受到严格限制,而且“一些公司不愿意向没有参加临床试验的病人提供药物”。美国安进公司曾为一组帕金森病患者提供试验药物,后来因为种种原因停止了药物供应。虽然病人认为该药有效,愿意继续试验,还向法院提起诉讼,但最终未能说服安进公司继续供药。试验申请者可在任何时候终止试验。当药物副作用过重,可能产生无法预料的风险,或者药效太好时(由于对照组未服用试验药物,对他们而言不公平), FDA也会终止试验。
医生向伯勒斯推荐的两种药物确实有一定疗效,但她没有得到参加易瑞沙临床试验的机会,而爱必妥的临床试验又只针对结肠癌。虽然相关法规已经允许病人使用通过Ⅱ期临床试验的药物,但开发易瑞沙和爱必妥的两家制药公司并没有为她破例,提供额外的试验药物。讽刺的是,这两种药物刚被证实为第三代表皮生长因子受体抑制剂,伯勒斯就去世了,而它们也很快就获得了上市批准。如今,爱必妥已被广泛用于治疗伯勒斯所患的癌症。阿比盖尔联盟的创始人之一,地质学教授史蒂文·沃克(Steven Walker)的妻子,也有类似的经历。2002年9月,沃克的妻子参加了爱必妥的临床试验。爱必妥的疗效让他惊叹不已:妻子竟然从卧床不起、濒临死亡的病人“变成”能滑雪、徒步旅行、每天散步的正常人。“但是,她的肝癌刚有点好转,制药公司就不再供药,2003年6月,我的妻子因无药可治而去世”。
该不该使用试验药物?
一些科学家认为对于重病患者,应该给他们选择的权利,由他们自己决定是否使用试验药物;另一些科学家却认为,让病人提前使用试验药物,可能破坏当前的试验系统,更可能给病人造成致命的伤害……
2007年2月,在食品与药物法律协会(the Food and Drug Law Institute,位于华盛顿的非营利性教育组织)出版的白皮书中,戈特利布指出,这场争论其实是两种观点的碰撞:是降低临床试验的标准,让病人提前使用试验药物,还是严格实施临床试验,得出有用数据,以作为未来用药的依据?
沙穆认为,如果不限制试验药物的使用,临床试验会更加繁琐,甚至失控。未经验证的化学药品有太多不确定因素,它可能比疾病本身更危险。而且,病人一旦能随意获取试验药物,就不再愿意参加对照试验(因为得不到试验药物),研究人员也就得不到有效的试验数据,新药开发进程将因此受阻。影响还不局限于此。FDA在陈述报告中指出,如果病人因为急于使用试验药物而向制药公司付费购买,会刺激这些公司的赚钱欲望,他们可能会跳过“费时费钱的临床试验”,直接销售“尚未批准的药物”。一些批评家认为,允许病人任意选择试验药物,还可能让某些新药过早“夭折”。如果重病患者用药不当,会引起非常严重的副作用,FDA就会终止这些药物的临床试验,那些真正需要这类药物的病人,就失去了康复机会。
沃克却有不同的看法。他认为,放开试验药物的使用权限,能让很多不能进行临床试验的病人获得用药机会,不会伤害到病人。因为根据阿比盖尔联盟的建议,任何想要使用试验药物的病人,首先就要申请参加临床试验。况且,没有人会选择有害或者无效的药物,医生也只会向病人推荐确实有效,或者至少是安全的药物。
佩里·科恩(Perry Cohen)是帕金森情报组织(Parkinson’s Pipeline Project,一个致力于加速医疗改革的病人组织)的创始人兼经理,他也认为病人能作出正确选择。“即使不会马上死去,重症病人也应该有权利权衡利弊,他可以先咨询医生,再作出是否使用试验药物的决定”。
然而,批评家极力反对上述观点。他们认为,在大规模临床试验之前,许多副作用是未知的。一旦有人拥有这种权利,势必会有更多的人提出同样的要求。
临床试验协会委员会主席柯林·贝格(Colin Begg)说:“允许病人选择未经批准的化学药物,并不意味着他们一下子就能得到适合自己的药物。”根据阿比盖尔联盟的建议,他起草了一份意见书,其中提到:“如果把整个药物开发领域看成一个‘药柜’,里面的药物其实大部分都是无效或有毒的,病人根本不知道使用哪种药物,因为医生并非药学专家,他们没有决定性证据指导病人用药。”
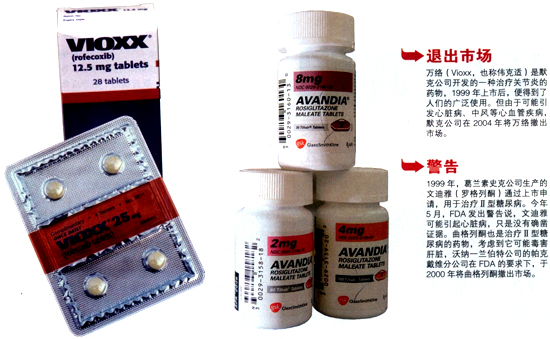
戈特利布认为,临床试验方案不必太死板,针对试验设计的改进方案将会缩短新药研发时间,精简对照组受试者的数量。他说:“我们有很多机会开发更好的试验工具,用于检测药物反应、改良试验方案。黄金准则即将失效,适应新模式的应急措施已经准备好了。”和沃克一样,科恩也主张加快试验药物的审批速度,然后在药物上市后,进行大范围监控。他说,现代信息技术、合理的实验设计以及贝叶斯统计学让这种方案变得可行。(不过,如果方案通过,FDA又可能面对新的指责:药物审批过快。镇痛药万络和抗糖尿病药曲格列酮就有审批过快的嫌疑,由于不安全,现在这两种药物均已退出市场。)
戈特利布解释说,贝叶斯统计学不需要“完美试验”,但要求“数据是真实、原始的……然后从非随机的数据集合中,发现各种可能性”。一个设计合理的试验是允许发生临时改变的(前提是要以试验数据为依据),即便试验正在进行。研究人员可以随时调整受试者人数,让更多的对药物有良好反应的患者参与试验。对于试验结果的预测,戈特利布、沃克和科恩都倾向于使用替代终点法(surrogate end points)。戈特利布说,这种方法能加速药物开发,使临床试验更有针对性,最后得到的结果也更可靠。FDA目前正在评审这些新技术。
“这些方法并非绝对可行,”贝格认为贝叶斯统计学适用范围相对较小,“这些方法不能迅速得出结果,反而会延长试验时间。根据替代指标也可能对试验结果作出错误预测。要判断哪种药物有用,哪种药物没用,必须在病人身上进行有效检验。”
临床试验协会在意见书中写道:“在药物研发的历史中,很多新药在最初的试验中都似乎很有疗效,病人、医生,尤其是研究人员充满了信心。但随着研究的深入,他们往往会发现,大多数药物都是无效的,甚至是有毒的。”仅癌症领域,就有很多失败的例子。在一次临床试验中,几千名乳腺癌患者接受了自体骨髓和干细胞移植后,又进行了高剂量化疗。整个试验花费巨大,患者们也痛苦不堪,然而所有努力并没有得到回报:试验方法的疗效不仅不如常规疗法,还让不少患者失去了生命。
可能的影响
因为阿比盖尔事件,保护胚胎干细胞的法规可能会被修改,“陈旧”的新药临床试验系统也可能得到进一步完善。
法院的决定不会涉及试验设计和利弊分析,只会与法律惯例和法律诠释有关。美国得克萨斯大学奥斯汀法学院的约翰·A·罗伯逊(John A. Robertson)说,如果阿比盖尔联盟胜诉,可能会推翻反对培育胚胎干细胞的法规,因为“根据阿比盖尔联盟的意见”,法院必须考虑“政府是否应该以病人的生命和自由为代价来保护胚胎”。
即使FDA仍将在新药审批过程中占据主导地位,一些改变还是会出现。FDA正在制订新的规则,简化试验过程。科恩表示,科学家必须意识到,临床试验系统已面临信任危机,原因之一就是坚持陈旧的“黄金准则”。无论“阿比盖尔事件”结果如何,FDA必须完善临床试验系统,使人们对药物重新树立信心。
请 登录 发表评论