惊天骗局:因肤色用药
撰文 乔纳森·卡恩(Johathan Kahn)
翻译 李雪芹
审校 王怀良
2005年6月23日,美国食品及药品管理局(FDA)批准首例针对某一种族的药物上市。该药名为拜迪尔(BiDil),是一种只用于治疗非裔美国人充血性心力衰竭的药物。(充血性心力衰竭是一种渐进性心肌功能减退疾病,患者无法有效地将心脏内的血液泵出。)人们普遍认为,此项批准是迈向药物个性化新时代的重要一步。在药物个性化新时代,科学家会针对个体的基因组成而专门设计某种药物。药物基因组学(pharmacogenomics)的研究有望成为一种降低药物成本,提高药物安全性和有效性的新途径。对于得不到充分医疗保障的非裔美国人来说,拜迪尔也被赞誉为一种可提高他们健康状况的有效药物。因此,美国黑人心脏病协会(Association of Black Cardiologists)和美国国会黑人同盟(Congressional Black Caucus)等组织强烈支持此药上市。
然而,仔细研究一下拜迪尔的“身世”,我们会发现它只是名义上具有种族特异性。首先,拜迪尔并非新药,它只是由两种普通药物——肼屈嗪(hydralazine)和硝酸异山梨酯(isosorbide dinitrate)组成的合剂。这两种药物用于治疗所有种族人群的心力衰竭已有十几年历史。其次,拜迪尔并非药物基因组学药物。虽然研究发现肼屈嗪和硝酸异山梨酯合剂可以降低心力衰竭患者的住院率和死亡率,但科学家并没有完全弄清它的作用机制,也尚未发现任何直接与种族基因有关的机制。最重要的是,目前没有充分证据证明拜迪尔对非裔美籍心力衰竭患者的治疗,比对其他种族患者的治疗更有效,或者有任何不同之处。FDA批准拜迪尔上市的主要依据,是一次仅有非裔美国人参加的临床实验结果,而这次实验并没有其他种族患者参与,药物的疗效也就无从比较。
那么,拜迪尔是如何被标榜为“种族”药物,又是如何成为医学新时代的先驱者的呢?拜迪尔的发展一直与不确定的科学研究、管理机构的监管障碍以及企业的商业动机密不可分。在过去的两年中,拜迪尔的市场影响力相对较小,仅有价值几百万美元的处方量,但它却显现出利用种族特异性而获准上市的危害性。尽管非裔美国人死于心脏病或其他疾病的平均年龄要低于白人,但大多数研究人员认为这种现象源于社会、经济等多种复杂因素。然而在一些医学专家和政策专家眼中,拜迪尔却成了一项证据,证明个体健康差别可以用基因差异性来解释。更严重的是,一些制药公司正在利用这一尚不确定的论据,去销售其他具有种族特异性的药物。这种趋势割裂了与医学的联系,却填鼓了药品制造商的腰包,并且无须对可能导致许多非裔美国人早逝的潜在原因作出任何解释。
拜迪尔的问世
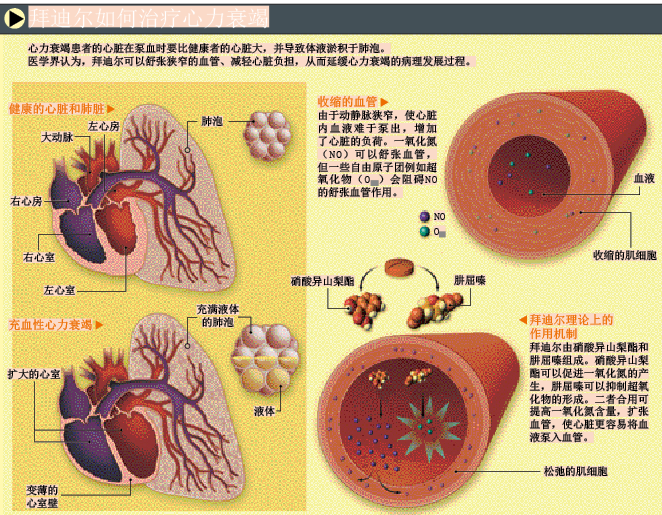
拜迪尔的传奇故事始于20多年前,人们为了评估血管舒张剂对心力衰竭的疗效,进行了多种研究。当时,心力衰竭使数百万美国人因心脏功能逐渐衰退而死,而医生们对这种病症的治疗,除了应用利尿剂(diuretic,通过减少体液量来减轻心脏负担的药物)和地高辛(digoxin,提高心肌收缩力的药物)外别无他法。20世纪80年代早期,美国明尼苏达大学的心血管专家杰伊·科恩(Jay Cohn)提出一种假说,将两种舒血管药物肼屈嗪和硝酸异山梨酯合用,通过舒张动静脉来减轻心脏负担。在美国退伍军人管理局医院的合作下,科恩设计了两组实验以证明他的理论。
第一组血管扩张剂心力衰竭实验(V-HeFTⅠ),主要比较肼屈嗪和硝酸异山梨酯合用与安慰剂及抗高血压药物哌唑嗪(prazosin)的疗效差异。实验结果表明,肼屈嗪和硝酸异山梨酯合用有很好的疗效。第二组血管扩张剂心力衰竭实验(V-HeFTⅡ)比较了肼屈嗪和硝酸异山梨酯合用与依那普利(enalapril)的疗效差异。[依那普利是第一代血管紧张素转化酶(ACE)抑制剂,通过抑制血管收缩肽的产生,起到降血压的作用。]这次实验结果显示,在抗心力衰竭方面,依那普利比肼屈嗪和硝酸异山梨酯合用更有效。至此,ACE抑制剂成为新一代治疗心力衰竭的一线用药。医生们仅给那些ACE抑制剂无效的患者推荐肼屈嗪和硝酸异山梨酯这两种价格便宜的药物。
然而,科恩仍然大力提倡肼屈嗪和硝酸异山梨酯合用的研发,他相信这两种药物合用会对心力衰竭有很好的疗效。1987年,他为肼屈嗪和硝酸异山梨酯联合应用治疗心力衰竭的方法申请了专利(因为肼屈嗪和硝酸异山梨酯本身是非专利药物,不能分别申请这两种药物的专利)——此时肼屈嗪和硝酸异山梨酯应用于所有人群,尚未考虑种族因素。继而,科尔将专利权转给北卡罗来纳州的一个名为默德科(Medco)的小制药公司,该公司于20世纪90年代早期首次将肼屈嗪和硝酸异山梨酯加工成合剂——拜迪尔由此问世。
1996年,默德科公司和科恩向FDA申请拜迪尔上市,并于1997年被拒。讽刺的是, FDA评审小组的大多数医生认为拜迪尔确实对治疗心力衰竭有效,并考虑在临床上应用。问题并非出在药物本身,而是出在血管扩张剂心力衰竭实验(V-HeFT)的统计数据上。此实验的设计只能用来验证血管扩张剂抗心力衰竭作用的假说,并不符合向FDA申请的监管标准。被FDA拒绝后,默德科公司的股票下跌了20%,公司决定将专利权转回给科恩。到1997年,拜迪尔的20年专利权已经过去了一半,也是默德科公司不愿再为此药投资的原因。
拜迪尔的重生
FDA拒绝批准拜迪尔后,科恩回顾了20世纪80年代的V-HeFT实验结果,并根据不同种族分类重新分析数据,发现拜迪尔对非裔美国人的疗效甚好。这种回顾性数据分析虽然可以为进一步研究提供参考,但也存在统计学上的缺陷,如果每一个组别中研究对象的样本数太少,结果可能会毫无意义。科恩认为在参与V-HeFT实验的研究对象中,拜迪尔对非裔美国人的疗效特别好,V-HeFTⅠ实验的结果尤其证明了这一点。但在参与此项实验的数千名被研究者中,非裔美国人只占了极少数——仅49人。1999年,科恩在《心力衰竭杂志》上发表了关于拜迪尔种族差异性假说的论文,并就此对拜迪尔申请了新的专利。新专利与原来专利唯一不同之处,在于拜迪尔只用于治疗非裔美国人的心力衰竭。但新专利的有效期是2000年到2020年,在原来专利基础上又延长13年。至此,拜迪尔改头换面,俨然成了一种具有种族特异性的药物。
获得拜迪尔作为种族特异性药物的专利后,科恩将此知识产权转让给了马萨诸塞州的一个小公司硝酸医药(NitroMed)。继而,FDA允许硝酸医药公司继续进行非裔美国人的心力衰竭实验(A-HeFT)。大约有1,050名非裔美国人作为受试者参与了该项实验。在A-HeFT实验中,一半心力衰竭患者服用了拜迪尔,另一半患者服用安慰剂,两组患者都继续服用原有抗心力衰竭药物(例如,每一组都有约70%的患者服用ACE抑制剂)。结果非常明显,服用拜迪尔患者的死亡率比安慰剂组低43%。鉴于拜迪尔良好的治疗效果,该实验的数据安全性监测委员会于2004年7月中止了这项实验,要求让安慰剂组患者也服用拜迪尔。硝酸医药公司股票因此在短期内上涨到原来的3倍。2005年6月,FDA正式批准拜迪尔作为具有种族特异性的药物上市,即表明拜迪尔只对黑人患者有效。
但是,研究人员有充足的理由相信拜迪尔对其他种族患者也同样有效。事实上,科恩自己也说过,他认为拜迪尔应该对所有种族患者有效。那么为何药物研制人员只针对某一种族患者做临床实验呢?答案看起来似乎更具有商业目的而非科学目的:如果FDA将拜迪尔作为所有种族人群均适用的药物批准上市,则此药的专利保护就到2007年为止;若将实验限定于非裔美国人,则会最大限度地提高拜迪尔作为种族特异性药物上市的机会,硝酸医药公司将获得比原来长13年的专利权,可以垄断性地销售拜迪尔。
被割裂的医学
长期以来,科学和商业总是共同推动医学的发展,但在拜迪尔事件中,天平似乎倾向了其中一侧。毫无疑问,科恩和其他医学研究者最初的确是想通过此药提高心力衰竭患者的生活质量。就此而言,拜迪尔的上市是一件好事。但科恩和硝酸医药公司也利用药物的种族特异性获得了巨大的商业利润。专利药物的价格大约是非专利同类药物的6倍。高昂的价格使保险公司不愿将此药纳入医保用药范围之内,数百万没有医疗保险的美国人因此难以承受。并且,由于媒体大肆宣传拜迪尔的种族特异性,使许多医生和患者认为非裔美国人以外的其他人种不适于服用此药——实际上,拜迪尔是有可能帮助他们延长生命的。
最严重的是,这项专利的授予及FDA对拜迪尔上市的批准,相当于联邦政府认可了利用种族来进行基因分类的做法。自从人类基因组计划开始以来,科学家们一直努力避免基因研究过程中出现的生物学知识被不恰当应用,避免使社会结构性的种族分类表现出生物性或自然性。正如2001年在《自然遗传学》(Nature Genetic)杂志上发表的一篇评论中所说:“科学家们一直强调,在基因水平上,同一种族中的两个个体间的基因,要比两个种族间的基因有更多的差异,种族差异没有生物学基础。”最近,《自然生物技术》(Nature Biotechnology)杂志的一篇评论声称:种族只是根据人类对环境或基因所致疾病或药物反应性不同而被分类的一个简单代名词,就如同动物学家把浣熊、老虎和鹿都称为有条纹动物一样。
FDA批准拜迪尔上市的理由,是他们接受了硝酸医药公司的观点:因为受试人群为非裔美国人,所以拜迪尔仅限于非裔美国人使用。这种族特异性标签传达出一个尚未被科学证实的信息,即受试种族对拜迪尔的安全性和有效性所表现的差异,在某种程度上与种族间的遗传多样性相关。目前,已上市的各种药物的研究对象绝大部分都是白人,但我们并没有称这些药物是“白人”专用药物。FDA的潜义词是,如果一种药物对白人有效,则对所有人有效。那么,同样的道理也应当适用于黑人。否则,FDA就是在暗示,黑人不能像白人那样完全代表人类。
2004年11月,《自然遗传学》杂志发表了英国伦敦大学学院的萨拉·K·泰特(Sarah K. Tate)和戴维·B·戈尔茨坦(David B. Goldstein)合写文章,题为《未来的药物是针对每个个体吗》。文中提到“据同行评审的科学或医学杂志报道,有29种药物(或合剂)在不同的种族中,有不同的安全性或有效性”。记者们立即引用此文作为不同种族有不同生物特性的依据。《洛杉矶时报》就刊登一则文章指出:“《自然遗传学》杂志在上个月发表文章称,29种已知药物对两个不同种族的人群有不同的疗效。”英国《泰晤士报》报道:“就在上周的《自然遗传学》杂志上,伦敦大学学院的萨拉·K·泰特和戴维·B·戈尔茨坦声称,有 29种药物对不同种族有不同的安全性和疗效。”《纽约时报》发表了一篇题为《面对第一例种族药物》的文章来讨论拜迪尔,并进一步指出,“据报道,有大约29种药物被证明对某一种族人群更安全有效,推测今后将会有更多的此类药物诞生。”
这些报纸曲解了《自然遗传学》杂志的文章。实际上,泰特和戈尔茨坦声称,虽然科学或医学杂志报道药物的安全性和有效性具有种族差异,但并未得到证明。在文中,他们还作了进一步说明:“这些说法具有普遍的争议性,种族差异到底对药物反应性有多大影响,目前尚无一致意见。”
在这29种药物中,泰特和戈尔茨坦发现,由于种族间的基因差异,导致患者服用过后有不同反应的,只有4种。(这4种药物全部是用于治疗高血压及其他心血管疾病的β 受体阻断剂;有研究表明,针对具有某个基因变异的人,这些药物有更好的疗效,而拥有这种变异的美国白人比非裔美国人更加普遍。)两位作者认为,白人和黑人对29种药物中的9种药物反应性各不相同,可能与他们潜在的生理基础有关。例如,有些科学家推测,生物酶活性的不同可能使ACE抑制剂对美国白人的疗效比对非裔美国人更有效。(其他一些研究者对此观点表示怀疑。)还有5种药物,泰特和戈尔茨坦发现没有生理上的原因可以解释药物反应性的差异。剩下的11种药物,他们认为关于药物反应性差异的报道可能是无效的。
种族不平等
无论如何,种族特异性药物正大行其道。2003年,美国加利福尼亚州的瓦克斯根生物药剂公司(VaxGen)曾经做过一次失败的尝试,分析了一种名为AIDS-VAX的爱滋病疫苗的种族差异。虽然临床实验表明,AIDS-VAX在整个人群中并没有降低爱滋病的感染率,瓦克斯根公司却声称,对黑人和亚洲人所做的临床实验表明,此疫苗可显著降低他们感染爱滋病的几率。实际上,只有几百名黑人和亚洲人参与了此项实验,也就是说,只需要少数几例爱滋病感染,就可以完全扭转实验结果。几年后在泰国进行的另一个实验表明AIDS-VAX无效,推翻了此疫苗具有种族特异性的结论。另一个例子,是英国阿斯特拉捷利康制药公司(AstraZeneca)声称,2004年针对亚洲人的临床实验中,治疗肺癌的药物易瑞沙(Iressa)表现出良好的效果。但对于总体人群,易瑞沙并没有提高研究对象的存活率(据尚不确定的消息,FDA改变了易瑞沙的药品标志,禁止此药用于新的患者)。最近,阿斯特拉捷利康公司对一种投资上百万的降胆固醇药物罗伐他汀( Crestor) 进行临床实验,参与者包括非裔美国人、南亚人和西班牙人。消费者声称罗伐他汀没有其他降胆固醇药物安全,但阿斯特拉捷利康公司却称此药对特定种族安全有效。
研究人员利用种族来推动药物研究的发展,目的也许是好的,但他们同时也受到了增强药物市场竞争力的驱使。拜迪尔事件说明研究人员和管理者都没有充分意识到,“种族”是一个强有力并且很容易传播的概念。这种利用“种族”来助长药物商业价值的做法会导致无规律的调控、低标准医疗水平及其他不幸的事故发生。FDA不应当在没有确切证据证明药物的安全性或有效性,对于不同种族所表现出的差异与种族间基因或生物学基础有关的情况下,就批准药物上市。批准更多像拜迪尔这样的药物,并不能降低美国不同种族间的健康差异。要纠正种族间的不平等,我们需要社会和政治力量的共同努力,而不是乱贴标签的药物。
请 登录 发表评论