假如我们通过之前的研究得到了可以作为原料药的化合物。然而,这种化合物要作为药品上市还要经过非常遥远的旅途。
临床试验分为三个阶段
开发出来的化合物首先用实验鼠或者实验犬来进行“安全性试验”(毒性试验)和观察药物是如何在体内循环的“药物动态试验”。这些试验都称为“非临床试验”。
通过这些试验确认了没有问题之后,再以人为对象,测试有没有副作用。这种试验称为“临床试验”。 试验一般分为3个阶段:“I期临床试验”、“II期临床试验”和“III期临床试验”。
在I期临床试验中,以健康人为对象,每次投入极少量的化合物,慢慢地增加投药量,调查安全性。在II期临床试验中,以几十个轻度患者为对象,调查有效性、安全性和投药量。最后的开发阶段即III期临床试验,以几百人到超过几千人为对象。进一步确认有效性和安全性。
通过这些试验,精密调查是否比现有的药物更有效,如果药物监管部门认证它更有效,才能够上市。
图1列出了整个新药创制过程。可见,从“找出病因”开始,到非临床试验、临床试验,再到药物监管部门认证,这一路走来,需要花费漫长的岁月。
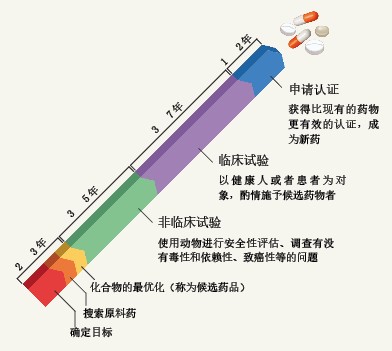
图1. 新药创制的流程
新药创制的流程图示。从找出引起病因的蛋白质,到新药上市为止,需要花费15~20年的岁月,耗费数十亿元的费用。
即使上市销售了,也绝对不能大意
药品在开始真正用于治疗之后,还要继续进行名为“上市后临床试验”的调查。还要调查有没有出现“预想外的副作用”等等,这也称为“IV期临床试验”。
例如对1000个人进行临床试验,即使没有发现重大的副作用,也许副作用会以万分之一的比例出现。又如在前文中看到的,药物和药物、药物和食物同时服用时,会发生不可思议的相互作用,出现不可想象的严重危害生命的副作用。虽然上市前已经进行过缜密调查,但是不能够完全排除这种危险性。因此,上市后的临床试验是非常重要的。
实际上,发生过在这个阶段的调查中发现预想以外的副作用、药品被撤架的情况。例如,治疗带状疱疹等的抗病毒药“索立夫定”(Sorivudine)1993年在日本上市。后来有报告称它和抗癌药氟脲嘧啶同时服用时,会导致白细胞减少等严重危害生命的副作用,发生过几个致死的案例。
新药创制成本的大半部分在临床试验阶段产生
右页上图显示通过了非临床试验的化合物,从进入I期临床试验开始,在整个临床试验进行过程中被淘汰的比例。随着临床试验的进行,大量的化合物被淘汰,最终能够成为新药的只有不到8%。虽然它们都是从大量的化合物中选出的原料药,实际得到药品认证的只是其中的极少一部分。
临床试验需要花费大量的时间和费用。可以说新药创制的整体成本中的一大半花在临床试验中。也就是说,只要减少在临床试验中被淘汰的化合物的数量,就能够减少新药创制的整体花费的时间和费用。因此目前正在研究在临床试验之前进行名为“微剂量临床试验”(或称0期临床试验)的方法。
所谓的微剂量(Microdose)临床试验,就是给健康人投入不超过预想药效显示所需的用药量的1/100的剂量,研究这种化合物在体内是如何循环、排泄的试验。优点在于投药量极少,所以即使出现副作用也几乎没有危险性。
今后,使用0期临床试验这种方法,有可能把进入I期临床试验的化合物直到最终药品认证的概率提高到30%。

图2. 进入临床试验阶段之后的化合物被淘汰的比例
世界各国研发的、进入临床试验阶段的化合物“原料药”,在临床试验的各期及审批中被淘汰的平均比例。I期到II期的淘汰比例约为40%;II期到III期的淘汰比例约为60%;最后能够成为药品的化合物,只占进入临床试验的不到8%。
创新药品在不同国家和地区的上市时间不同
也许你听说过“药滞”(drug lag)一词吧?这就是不同国家和地区能够使用新药的时间不同。和其他多数国家相比,中国新药认证的时间滞后较为明显。
例如2010年获得认证的药品,从进入I期临床试验到上市花费的平均时间为4.7年。而美国是0.9年,英国是1.2年,德国是1.3年。和这些国家相比,中国创新药品的上市时间也是滞后的,日本等国也一样。原因就是临床试验开始时间滞后或者临床试验花费的时间长。
中国目前创新药品不多,新药主要靠进口。任何一种药首先是在一个国家上市,然后再到另一个国家。创新药往往都是在美国、欧盟、日本、加拿大、韩国、澳大利亚等,上市,然后再到另一个国家。
过去为什么一种新药在另一个国家上市会滞后,原因是一种创新药进入一个国家以后,必须要得到这个国家药品监管部门的审批。各个国家的审批要求又不一样,比如,进入中国的创新药品应该要完成一些中国人人体试验的数据,包括有效性和安全性。因为人种差异,每种药品在不同人种身上的反应是不一样的,所以必须摸索到在中国人身上的有效剂量和不良反应的程度,这也是保证中国公众用药安全的一项举措。所以进入中国的创新药往往比国外会晚一两年或两三年,有的加上审批甚至达到五六年。这在其他国家也是共有的现象。
过去的法律制度规定,国外的药品到中国来,必须要批准,必须在国外上市以后才能到中国来。一般是国外做了Ⅱ期临床,到中国来才能申请Ⅰ期;做了Ⅲ期,才能到中国做Ⅱ期,目的是不要在中国人身上做试验,做完了以后,数据准确,觉得可靠,再来中国做试验。这种出发点是好的,保护中国公众。但问题是,一些新的特效药不能及时上市。
近来,中国在新药审批制度上进行了改革,支持“国际多中心临床试验”。也就是一种创新药可以在全球几个国家或某区域内几个国家同时进行临床试验,这样会大大加快进口药品上市的时间。
仿制药的优点和缺点
所谓仿制药(generic drug),就是制药商用专利保护期已满的药品(原研发药)的有效成分开发出来的药品。因为比原研发药的开发费用少,所以比原研发药价格便宜,这是仿制药的优点。关于仿制药的有效性,制药商也进行了各种试验,并且只有药效和原研发药相同这一点得到确认后,才能被药物监管部门认证。
但是,使用仿制药时必须注意,虽然它的有效成分确实和原研发药完全相同,但是其他成分却不一定相同。就像在前面介绍过的那样,药品不仅含有有效成分,还含有其他物质,如使药效稳定的添加剂、改善药品气味的添加剂等等众多的添加剂。有些添加剂也有专利保护期限。专利保护没有到期的添加剂就不能用在仿制药中。结果,仿制药的吸收量、生效时间等会受到影响。仿制药药效降低以及发生过敏反应的情况也时有报道。
当然,仿制药中也有和原研发药完全相同的。不过,对于癌症或者心律不齐的患者,如果要由原研发药改用仿制药,需征询医生的意见之后再作决定为好。
(本文发表于《科学世界》2015年第11期)
请 登录 发表评论