电池的进化极大地改变了我们的生活。现在,手机、笔记本电脑等产品正在小型化和无线化,我们已能够随意携带,这在很大程度上得益于锂离子电池的发明。
电池(化学电池)主要分为两大类,一类是“用完就扔掉”的电池(一次性电池),另一类是可充电的反复使用的电池(二次电池)。这两大类电池中又各有不同,而且不同的电池有不同的性能和电压。
就拿电池的电压来说,一次性电池中的锌锰干电池和碱性干电池,它们的电压都是1.5V(伏);二次电池中的镍镉电池和镍氢电池,它们的电压都是1.2V;锂离子电池的电压是3.7V。根据用途选择不同的电池是很重要的。那么,电池的性能又是如何决定的呢?
电极的组合方式决定电压的大小
电池(化学电池)是一种通过化学反应产生电的装置。氧化反应释放电子,还原反应得到电子,这两种反应分别在不同的场合进行,将它们用导线连接起来,导线中就产生了电子的流动(电流)。放电时,在“负极”发生氧化反应 ,在“正极”发生还原反应。为了促使各个反应分别在正极和负极发生,在它们周围存在着“电解质”。另外,在实际的电池中,为了防止正负极相连发生短路,正极和负极是用绝缘的“分隔装置”分隔开的。
形成电池的氧化和还原反应都是很容易发生的化学反应。举个例子,如果在铜片和铝片中间夹进几张渗入盐水的餐巾纸,将餐巾纸重叠,然后把铜片和铝片用导线连接起来。铝从铝片上溶解进盐水时,电子就释放在导线上,铜片从导线处获得电子,这样就在导线上形成了微弱的电流。这种“电池”的铝片是负极,铜片是正极,盐水是电解质。
易于释放电子(被氧化),或者易于获得电子(被还原),其难易程度随着物质的不同而不同。例如,金属释放电子的难易度可以用 “金属的离子化倾向”来表示。另外,电池的电压也是由各种物质的“电子释放的难易程度”和“获得的难易程度”来决定的。
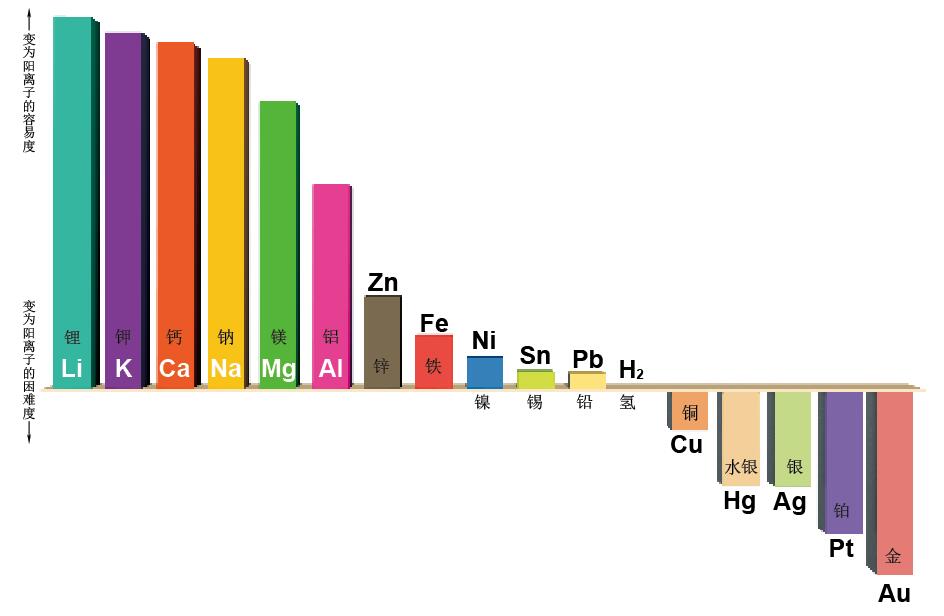
图1. 与电池性能相关的“金属的离子化倾向”
图为金属的离子化倾向表,表示变为阳离子的容易度(金属的离子化倾向与金属的活动性是一致的,离子化倾向越强就越活泼)。越往图左侧,表示越容易释放电子变为阳离子,也就越容易做电池的负极。越往右侧就表示越容易得到电子,越难于变为阳离子,也就越容易做电池的正极。另外,正负极金属的离子化倾向差别越大,就越有大量的电子同时移动,也就越能制造出电压很高的电池。只是,由于图左侧的锂、钠、钾活动性非常强,遇水会急剧反应产生氢。所以,它们在金属的状态下不能用于制造含有水分的电池。
干电池的发明
电池的历史可以追溯到1800年发明的伏打电池。后来,1888年德国的查理·加斯纳(Karl Gassner)发明了干电池。自此,电池才广泛应用。在此之前,电池中使用液体电解质,携带十分不便。加斯纳把石膏的粉末混入液体之中,这样液体就流不出来了。另外,据说在加斯纳之前的1885年,日本的屋井先藏研发了干的电池,并将这种干的电池命名为“干电池”。
现在,我们常见的干电池就是锌锰干电池和碱性干电池。这两种电池的相同之处在于它们的电极都使用了锌和二氧化锰。因此,这两种电池无论哪种,电压都是1.5V。但是,碱性干电池将负极上的锌加工成了糊状,这样就大大地增加了负极的表面积,可进行大电流放电,从而提高了电池的性能。另外,碱性干电池的电解液里使用的是比较容易导电的碱性溶液,所以,相比锌锰干电池来说,它的特征就是可以高效地产生电流,并且电压下降比较缓慢。这样一来,即使两种电池使用的是同一种材料,它们的性能也会随着电极形状和配置的不同而有很大的差别。
镍镉电池和镍氢电池
可充电电池(二次电池)开始于1959年法国物理学家加斯顿·普兰特(Gaston Plante)发明的铅酸蓄电池。随后,二次电池中的镍镉电池、镍氢电池、锂离子电池相继开发出来。
特别是无线化以来,可以携带的手机得到普及,这就更少不了二次电池的应用。举个例子,在手机诞生之际,手机里装载的是镍镉电池,之后被镍氢电池取代,现在所有的手机都已换成了锂离子电池。可以说伴随着电池的进步,手机也同步实现了机体的小型化和使用时间的延长。
镍镉电池的电压在1.2V左右,由于它能够实现大电流放电,所以通常使用于短时间使用的充电式剃须刀和电动牙刷等。随后出现的镍氢电池的电压与镍镉电池一样都是1.2V,容量(关于容量稍后会做详细说明)却是镍镉电池的2倍。因此,镍氢电池的出现对当时电器设备的小型化做出了很大的贡献。另外,再加上镍镉电池中使用的镉毒性很强,所以现在大都被镍氢电池所替代。
在售的镍氢电池有多种品牌,是我们周围最常见的二次电池之一。因其现售型号与干电池几乎相同,所以,越来越多地替代碱性干电池和锌锰干电池。
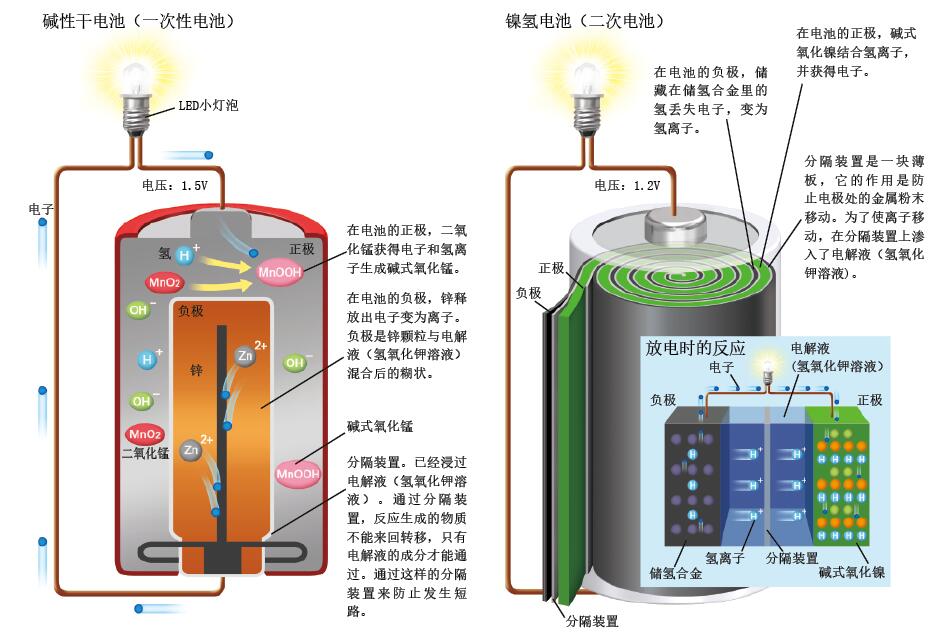
图2. 我们常见的电池的结构:碱性干电池和镍氢电池
左图:电子从容易释放电子的锌(负极)一侧流向容易获得电子的二氧化锰(正极)一侧,这样就产生了电流。负极:Zn+4OH-→[Zn(OH)4]2-+2e-,正极:2MnO2+2H2O+2e-→2MnOOH+2OH-。
右图:氢离子在负极(储氢合金)和正极(碱式氧化镍)之间转移,就能够进行充放电。负极:MH+OH-→ M+H2O+e-,正极:NiOOH+H2O+e- → Ni(OH)2+OH-。
(本文发表于《科学世界》2016年第4期)
请 登录 发表评论