光的“波粒二象性”
爱因斯坦指出光是带有粒子属性的。另一方面,在量子论出现以前,人们一直认为光是一种波。
比如说,我们能看到色彩斑斓的肥皂泡,这个现象背后的原理是光的“干涉”,这是一种波所特有的现象。也就是说“光在具有波的性质的同时,也具有粒子的性质”(所谓的“光的波粒二象性”)。
令爱因斯坦困惑不已的光的奇特性质
但是,既然是波,就是一种在空间中延展存在的东西。通常来说,不能针对空间中的某一点说:“波在这里”。而粒子,就意味着总是在空间中的某一点存在的东西。
如此想来,光怎么能够既是一种波,又是一种粒子呢,这不是相互矛盾的吗?实际上在爱因斯坦发表光量子假说的时候,当时的物理学家几乎都相信光是一种波,所以这个假说也没有立即获得支持。
爱因斯坦自己也被光的这种不可思议的性质困扰了一生。他曾经说:“虽然对‘光量子是什么’这个问题不断地思考了50年,但却从来没觉得接近过答案。”(出自约翰·里格登著《爱因斯坦的奇迹年1905》)
对于这个现代物理学中的不可思议的二象性的解释,我们留到后面再说。
玻尔的原子模型
在20世纪初的物理学界中,还有另一个很大的谜题,这就是关于原子所发出的光的颜色问题。
在盛满氢气的容器中放电,氢原子将会发光。把这束光通过被称为“棱镜”的光学器件后,我们知道光将按照波长进行分解。当时已经知道,氢原子能够放出的光有4种,即红色、绿色、蓝色和紫色。
另一方面,将太阳光或者白炽灯发出的光通过棱镜后,会连续地分解成无数种颜色(或者说是彩虹色)。也就是说,氢原子发出的光的颜色是一段一段的、不连续的。为什么氢原子只发出这些特定颜色的光,令人迷惑不解。
电子的轨道是分立的→发出的光的颜色也是分立的
1913年,丹麦物理学家尼尔斯·玻尔(1885~1962)套用普朗克的量子假说,构造了一个原子模型,该模型认为原子内部的电子所携带的能量也是一份一份的。如此一来,允许电子存在的轨道也就变成是分立的了。
所以,“当电子从高能轨道去到低能轨道的时候就会发光,光的能量等于轨道之间的能量之差。由于电子的轨道是分立的,所以它发出的光的颜色(波长)也就变得分立了。”而且光的能量是由波长(波峰到波峰的距离)决定的。波长长的(更靠近红色)能量低,波长短的(更靠近紫色)能量高。
用这个模型进行计算,结果和实验符合得非常好。原子发出的光之所以是分立的,正是由于电子轨道的分立造成的。
电子的“波粒二象性”
玻尔指出了“原子内的电子只能存在于分立的轨道上”,为什么电子只能存在于分立的轨道上呢?
1923年,法国物理学家路易·德布罗意(1892~1987)指出,既然光能够具有波和粒子的二象性,被认为是粒子的电子就不能带有波的属性吗?(电子的“波粒二象性”)
如果电子具有波的属性,就限制了其可以存在的轨道
电子的轨道应该是围绕着原子核周围的一个圆。德布罗意认为只有在那些周长与电子的波长配合得“非常好”的轨道上,电子才能稳定地存在。图1中,1个波峰(虚线圆外侧)加上1个波谷(虚线圆内侧)算是1个周期,轨道1周中正好有4个周期。图2中正好有5个周期。像这样,电子波与轨道周长满足了一定的关系,电子才可以在这些轨道上稳定地存在。
另外,德布罗意认为像图1’中那样无法满足这种关系的轨道,电子波也无法稳定地存在。在这样的轨道上,也就不存在电子。
不过,人们一直认为电子是一种非常小的粒子。本应该是粒子的电子同时具有波的性质,这到底意味着什么呢?
需要注意的是,根据量子论,单个电子就同时具有粒子和波的性质※。虽然当大量的电子聚集在一起的时候,也可能产生整体的波动行为,但与这里所说的意思并不一样。这里的的意思也不是单个电子自己在蛇形地向前运动。
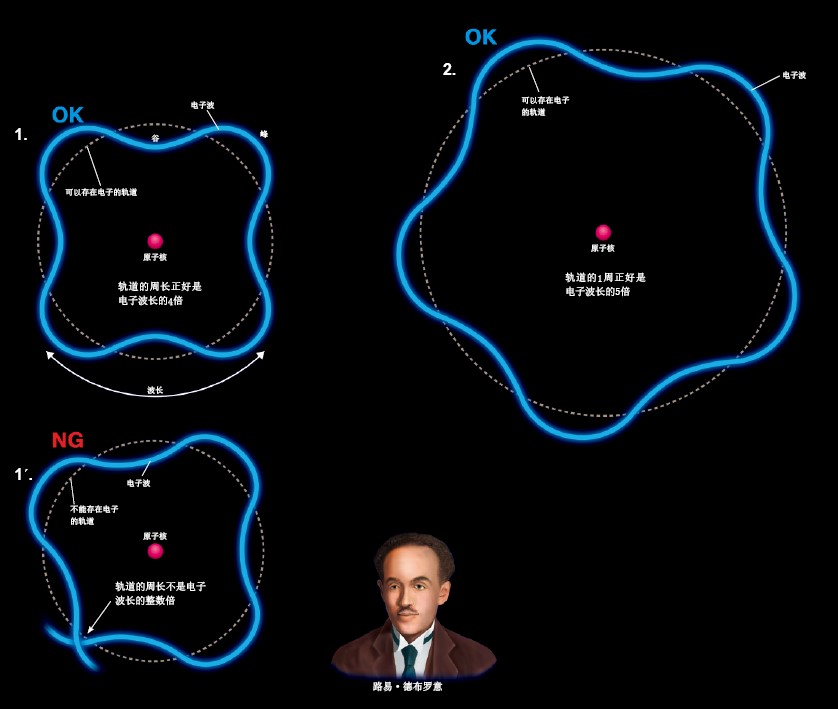
电子波与电子轨道的关系
在图1和图2中,轨道的周长正好是电子波长的整数倍。德布罗意认为在这样的轨道上,电子是可以存在的。在图1´中轨道长度与电子周长的关系发生错位,在这样的轨道上电子不能存在。
(本文发表于《科学世界》2013年第9期)
请 登录 发表评论