原子之间的结合就像插件一样
由于原子间作用力的多样性和复杂性,原子组合成复杂的空间立体结构,构成不同形状的分子、原子团或原子晶体,结构不同表现出的性质也不同。两个原子结合的能量不同,稳定性就不同,一般是结合能越高越稳定。原子团中一般有多个原子,有的原子结合稳定,有的不稳定,化学性质由最不稳定的两个原子的结合能决定的。
水分子是由2个氢原子互成104.5°角连接在1个氧原子上,氢与氧之间是极性共价键结合的,也就是说它们的共用电子(云)偏向于氧原子。如果氢、氧、氢原子排列在一条线上,水分子就不会有极性,但由于2个氢原子偏离一定角度,水分子是个极性分子,这使得水成为一种很好的溶剂。地球上发生的许许多多现象都与水有关,它更是我们身体中不可缺少的物质。二氧化碳也是由极性键构成的,但2个氧原子对称分布在碳原子两边,呈哑铃状,分子整体不显极性,正常情况下是气体。
我们通常说的化合物都是以简单的分子式来表示,比如水分子表示为H2O,二氧化碳表示为CO2,二氧化硅表示为SiO2,显示不出它们的结构。实际上原子的结合真正成为简单分子的是少数(常温下大部分为气体),大部分以原子晶体的形式存在。金属键、离子键结合的物质都是大量的原子结合在一起,共价键结合的物质很多也是原子晶体。二氧化硅与二氧化碳很相近,但结构完全不同,表现出完全不同的性质。到处可见的沙子就是二氧化硅,玻璃也是二氧化硅,1个硅原子以共价键与4个氧原子连接,4个氧原子又分别连着其他硅原子,这样的结构非常稳定。
图中给出了部分可形成共价键的结合及常温常压下的结合能(键能),键能越高,结合强度越大,就越稳定。
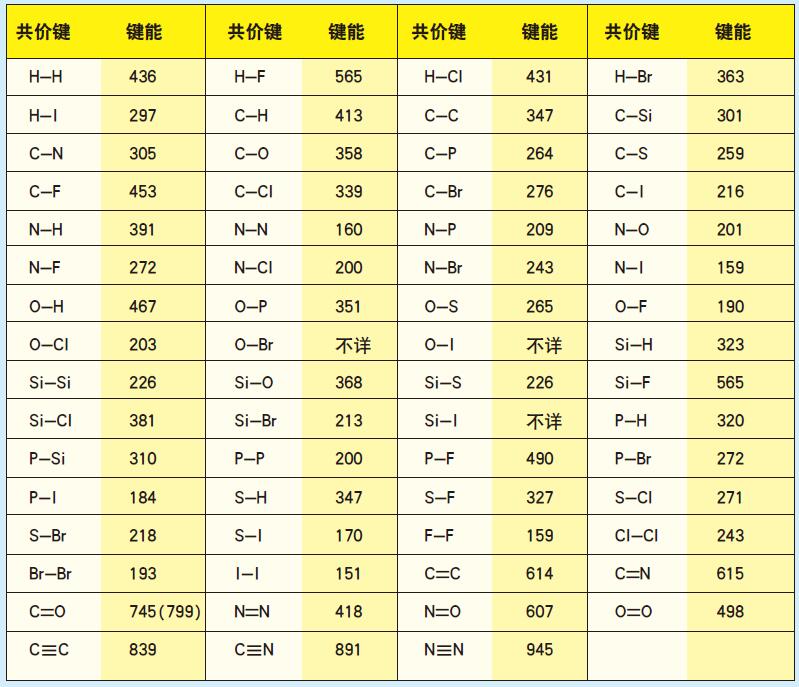
部分共价键的键能
图中数据的单位是千焦耳/摩尔,可以除以阿弗加德罗常数换算为一个键的能量,再除以电子电量,单位变为电子伏特。
相同的原子连接不同显示的性质不同
相同的原子连接在不同的位置,会显现出截然不同的性质,我们说这是同素异构体。最典型的例子,就是石墨和金刚石。石墨和金刚石的分子构成均为同样数量的碳原子,但是因为碳原子之间的空间架构关系不同,结构方式不同。石墨原子间构成正六边形的平面结构,呈片状。金刚石原子间是立体的正四面体结构,呈金字塔形结构,从而形成了物理性能差别极大的两种物质——石墨很软,而金刚石则特别坚硬。其化学性能及经济价值也差别极大。
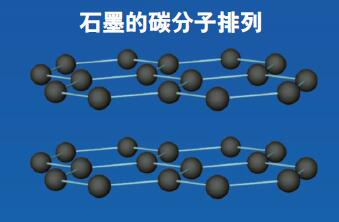

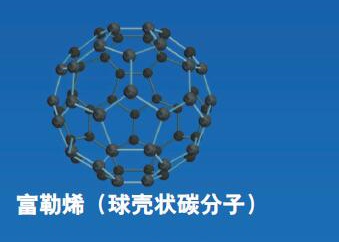
碳单质的同素异构体
再如,甲醚和乙醇(酒精),两者都是具有相同数目的碳原子、氢原子和氧原子组成的。但由于其空间排列结构不同,便形成了两种不同的物质——乙醇是液体,能溶于水;而甲醚则为气体,不溶于水。
有些分子原子种类和数量相同,原子间的连接也相同,但旋转方向不同,也表现出不同的性质。
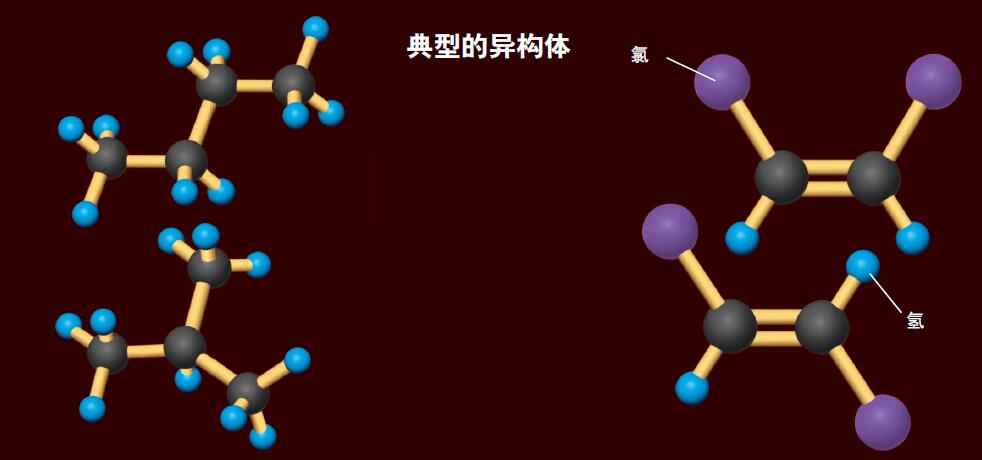
典型的异构体
【左】构造异构体:构成分子的原子的种类和数目都相同,但是原子的连接方式不同,这些不同的物质叫做构造异构体。
【右】立体异构体:构成分子的原子种类和数目相同,连接方式也相同,但是连接的“方向”不同,这些不同的分子叫做立体异构体。
请 登录 发表评论