原子组合起来的分子可以再分解
原子组合为分子只是保持在相对稳定的状态,或者说原子之间相互“捕获”在势井当中,在一定的温度下,分子中的一个原子相对另一个原子保持振动状态,随时都有“跃出”势井的趋势。当温度升高时,原子就会获得能量,振动加剧;一旦原子获得足够的能量,超出了势井的“深度”,原子就会分离开,重新成为单原子。
自然界中绝大部分金属都不存在单质,而是以化合物形式存在,通过加热可以使金属化合物分解。如人们早就知道通过氧化汞可以得到汞(水银),拉瓦锡就用加热的方法使氧化汞分解为汞和氧气,发现化学反应中反应物的质量总和与生成物的质量总和是相等的,而且反应前后各元素的质量也保持不变。氧化汞加热分解后,汞原子与汞原子重新组合在一起,而氧原子与氧原子组合在一起,化学反应就是这样先分解然后再化合的过程。
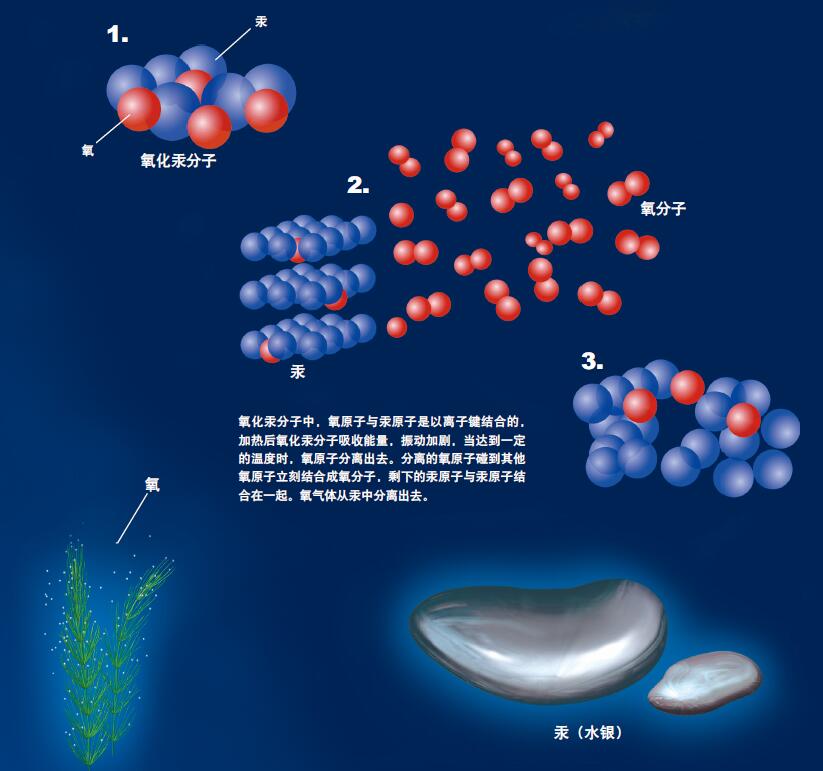
氧化汞分子中,氧原子与汞原子是以离子键结合的,加热后氧化汞分子吸收能量,振动加剧,当达到一定的温度时,氧原子分离出去。分离的氧原子碰到其他氧原子立刻结合成氧分子,剩下的汞原子与汞原子结合在一起。氧气体从汞中分离出去。
除了加热之外,还可以通过光照、粒子撞击(加热也是粒子之间的碰撞加剧)、电解等方法给原子提供能量,把分子分解为原子。如氯化钠加热到900℃左右成为液态,电解后就获得钠和氯气。
由于分子获得能量就可能发生分解反应,从而改变物质原来的结构,是材料的变质或老化的原因之一。自然界中到处充满了能量和能量的交换,热、光、电、辐射等都可能使分子发生分解,如颜料长时间暴露在日光下就会褪色。
分子能够分解才可能发生化学反应,有些物质在常态下就可发生化学反应,而有些物质之间不能发生化学反应,但可以改变条件如调整温度、压力、电场、辐射等,促使其发生分解化合反应。
燃烧过程是原子之间的重新组合
我们一般说的燃烧是燃料物质与空气中的氧气进行的剧烈化学反应,放出光和热量,如木材、煤气等的燃烧。燃烧的最基本特征是剧烈的化学反应,放出光和热,从这个意义上来说,一切剧烈的氧化反应都是燃烧,不一定必须有氧气的参与。比如氢气与氯气的反应、金属钠与氯气的反应等。
我们目前使用的能源大部分都来自燃烧释放出来的热能,煤炭、石油和天然气等的燃烧本质上是燃料物质分子与氧分子中的原子重新组合,释放出化学能的过程。那么这种重新组合是怎样发生的呢?
氢气的燃烧是个比较简单的例子,氢原子和氧原子分别以相对稳定的氢分子(H2)和氧分子(O2)存在,在标准状态下(即标准的温度和压力,可理解为我们所处环境的平均状态),要分开氢分子需要4.53电子伏特的能量,把氧分子分为2个氧原子需要5.17电子伏特的能量。因为它们由原子组合成分子释放出过能量,也就说它们有一定的结合能。当它们碰到一起时,正常情况下并不能发生燃烧,会缓慢地进行反应。通常情况下2个氢分子和1氧分子重新组合为2个水分子(H2O),必须先要有2×4.53+5.17=14.33电子伏特的能量,4个氢原子和2个氧原子组合成2个水分子要释放出2×2×4.85=19.4电子伏特的能量。这个过程净释放出5.07电子伏特的能量。水分子是比氢分子和氧分子更稳定的分子。
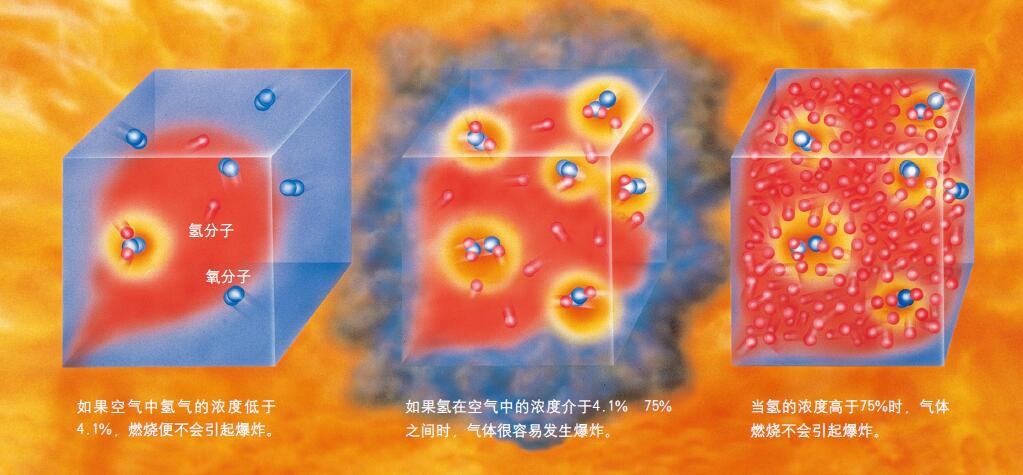
氢的浓度决定了它的燃烧方式
当氢的浓度在4.1%~75%之间时,是很容易引起爆炸的。如果氢在空气中的浓度低于4.1%,那么它燃烧得就很缓慢,释放的能量也较少;当氢的浓度大于75%时,氢气与氧气的接触不充分,反而不会引起爆炸。
燃烧是放热反应,一般都可自发地进行。为什么一般燃烧需要点火呢?比如生炉子、划火柴、点蜡烛等先要用火种引燃材料,才能持续燃烧。我们还是来看看氢与氧的反应,在常温常压下,气体分子都有一定的能量(能量分布遵循波尔兹曼分布),总有少量的分子具有较高的能量,使得氧分子分解为氧原子,氧原子碰到1个氢分子会生成1个水分子。这个过程非常缓慢,但是当把气体(燃料)加热时,分子间激烈碰撞,会有更多的分子被分解为原子,反应速度就加快了,同时放出热量。温度达到所谓的“燃点”时,反应放出的热量能继续加热其他的分子,维持一定的反应速度,燃烧就持续进行(一种链式反应)。燃料和氧气源源不断供给时会产生火焰式燃烧,燃料与氧气(或氧化剂)按适当的比例和方式混合起来,点燃时会发生爆燃,也就是爆炸。日本福岛第一核电站事故中厂房的爆炸就是氢气与空气混合到一定的比例造成的。
请 登录 发表评论