周期系统的演变
Eric Scerri
从大约200年前诞生以来,周期表就成了现代化学研究中不可或缺的工具。
元素周期律是科学上最强有力的现象之一:一个把我们的许多化学知识融为一体的独一无二的文献。它是一种几乎挂在世界上每一个化学实验室与演讲厅里的图表。的确,在其他学科中没有什么与它完全相似的东西了。
对元素进行分类的周期系统的历史可以追溯到200多年以前。在它的整个漫长的历史中,随着科学的进展与新元素的发现而引起争论、改变与改进(见本期“制造新元素”)。
尽管自上一个世纪以来,科学发生了巨大的变化——即产生了相对论与量子力学——但是周期系统的基本性质仍然没有变化。在一些情况下,新的发现起初似乎对周期表的理论基础提出了怀疑,但是每一次在保留周期表的基本结构的同时,科学家们最后都把研究成果包括进去。显然,周期表因它的历史根源与现代意义而非常引人注目。
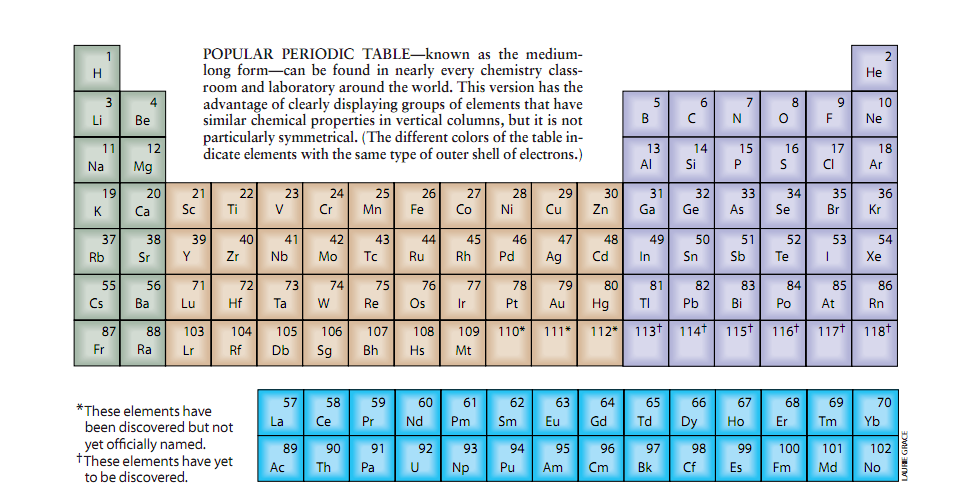
“周期性”这个术语反映了化学元素以一定规律的间隔显示其化学特性模式这一事实。如果不是周期表提供这么简化的东西,学化学的学生就需要去记忆所有112个已知元素的特性。幸运的是,周期表让化学家们掌握少数典型元素的特性就够了,所有其它的元素属于具有类似化学特性的所谓的类或族。(在现代周期表中一个类或一个族对应于一个垂直的纵列。)
对元素进行分类的周期系统的发现是许多科学发展的顶点而不是出自某一个人一时的美妙的主意。但是历史家们一般将下述事件作为现代周期表正式诞生的标志:1869年2月17日,俄国的化学教授第米特里·伊万诺维奇·门捷列夫完成他众多周期表中的第一个。它容纳了按照原子量递增排列的63个已

知元素;门捷列夫也为还未发现的但他已预测出原子量元素留下了位置。
但是,在门捷列夫的发现之前,另外一些科学家也提出了一些描述元素的组织系统。例如,1787年,与Antoine Fourcroy,Louis Bernard Guytonde Morveau和Claude Louis Berthollet一起工作的法国化学家Antoine Lavoisier设计了一个当时已知的33种元素的图表。但是这样的图表属简单的一维表示法。现代周期表的优点在于它在一个列与行精确地排序的逻辑系统中两维、甚至三维显示所有已知元素(甚至还未发现的元素)。
在一个将元素组织成为有意义的排列的早期尝试中,德国化学家Johann Döbereiner在1817年指出,可以根据相似性将许多已知元素排列成他称为三元组的三式类。Döbereiner挑选出锂、钠与钾,以及氯、溴与碘这些元素的三元组。他注意到如果按照原子量将一个三元组的三个成员排序,那么中间元素的性质就介于第一个元素与第三个元素的性质之间。例如,锂、钠与钾都与水强烈地反应。但是该三元组中最轻的元素锂则比其它两个元素的反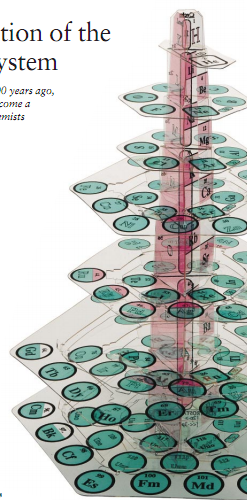
应要弱一些,而三个元素中最重的元素钾则发生剧烈爆炸反应。Döbereiner还证明中间元素的原子量接近三元素中第一个成员与第三个成员原子量的平均数。
Döbereiner的工作激励了其他人研究元素的化学性质与它们的原子量之间的相关性。19世纪,进一步贯彻应用三元组方法者之一,克隆的PeterKremers提出某些元素可以属于垂直排列的两个三元组。Kremers从而通过比较处在两个方位的元素开辟了新天地,这是后来被证明是门捷列夫系统的一个基本方面的一个特点。
周期性
门捷列夫系统的关键特征是它说明了元素的性质,按一定规律间隔的周期性,即重复性。这一特点以前曾被法国的地质学家Alexandre Emile Beguyerde Chancourtois在根据原子量设计的元素排列中观察到。这一系统取决于相当错综复杂的几何构型。Chancourtois按照原子量的大小沿着画

在援助表面上的并倾斜至与基部成45°的螺线配置元素。
螺线的整个第一圈与元素氧重合,整个第二圈则在硫上。在圆柱表面上垂直地排成一列的元素,往往有类似的性质,所以这种排列成功地获得了以后成为门捷列夫系统中心的一些模式。但是,因为某些原因,Chancourtois的系统对当时的科学家没有太大的影响:他的最初的论文没有图表,系统相当复杂,没有是人很信服的现实元素中的化学相似性。
另外几个研究人员在19世纪60年代提出了他们自己对周期表的简介。英国化学家John Newlands用原子量的新标准化值在1864年提出,当元素按原子量的顺序排列时,任何一个元素都显示类似于表中前第8位与后第8位元素的性质——Newlands成为“八行周期律”的这样一个特点。
在他最初的模型中,Newlands为未知的元素保留了空位,但是在他更为人知晓的1866年模型中却没有包括这些空位。其他化学家立即对这个表提出了反对意见,因为它将不能够容纳可能被发现的新元素。实际上,一些研究人员公开嘲笑Newlands的想法。1866年在伦敦的化学学会的一次会议上,伦敦大学的George Carey Foster问Newlands他是否考虑按字母顺序排列元素,因为任何种类的排列都会带来一些偶然的巧合。作为会议的一个结

果就是,化学学会拒绝发表Newlands的论文。
尽管不被人接受,但是,Newlands的研究确实是人们使用一系列序数(在这种情况下,根据的是原子量顺序)来组织元素的第一次。从这一点来看,Newlands率先提出了以通常所说的原子序数顺序作基础的周期表的现代组织结构。(表示存在于原子核内的质子数的原子序数概念是20世纪初期才建立起来的)。
现代周期表
在1868年修订自己的化学教科书的过程中,德国布雷斯劳大学的化学家Julius Lothar Meyer提出了一个证明是很类似于门捷列夫的著名的1869年模型的周期表——虽然他没能对所有元素作出正确的分类。但是这个表由于出版者的延误直到1870年才出现在印刷品中——这是导致随后在Lothar Meyer与门捷列夫之间发生激烈的优先权争论的一个因素。
大约就在同时,门捷列夫也在写一本化学教科书时组建了他自己的周期表。门捷列夫不同于他的前人,他对自己的周期表有充分的信心,可以用其来预测几个新元素及其化合物的性质。他还修正了一些已知元素的原子量。有意思的是,门捷列夫承认看见过某些较早提出的周期表,如象Newlands的那些表,但是他声明,在他提出自己的周期表的时候,并不知道Meyer的研究。
虽然从预测这一点来看,门捷列夫周期表有巨大的进展,但它似乎被历史家们过分强调了,他们普遍认为门捷列夫周期表特别是因为这个特点才被接受的。这些学者没有注意到,随Davy奖章一起由伦敦皇家学会颁发的荣誉状(门捷列夫在1882年接受的)对他的预测只字未提。相反门捷列夫排列已知元素的能力与他惊人的预测可能对人们认可周期系统具有同等重要的作用。虽然许多科学家帮助提出了周期表,但是门捷列夫接受了发现化学周期性的大部分荣誉,因为他把这一发现提升为自然规律,并且用他的余生来勇敢地验证它的结果与捍卫它的正确性。
捍卫周期表不是一项简单的工作——它的准确性经常受到后来的发现的挑战。一个值得注意的例子发生在1894年,当时伦敦大学William Ramsay与伦敦皇家学会的Rayleigh勋爵(John William Strutt)发现了元素氩。以后几年,Ramsay宣布鉴定了另外4种元素——氖,氖、氪与氙——称为稀有气体。(已知稀有气体中的最后一个氡是德国物理学家Friedrich Ernest Dorn在1900年发现的。)稀有的这个各称来源于这样一个事实:所有这些气体似乎与其它元素无关,难得与它们相互作用以形成化合物。所以,一些化学家提出,稀有气体甚至不属于周期表。这些元素没有被门捷列夫或其他的任何人预测过,只是在经过6年紧张的努力后,化学家们与物理学家们才成功地将这些稀有气体结合到周期表中。在新的排列中,在卤素(气态元素氟、氯.溴、碘与砹)与碱金属(锂、钠、钾、铷、铯与钫)之间引进了一个附加的纵列。
争论的第二点围绕在元素排序的准确性上。门捷列夫原来的表是按照原子量排列的,但是在1913年荷兰的业余理论物理学家Antonvanden Broek提出,周期表的排序原则应代之以按每个原子的核电荷数安排。同年在曼彻斯特大学工作的物理学家Henry Moseley检验了这一假说,但是不久以后他悲剧性地死于第一次世界大战。
Moseley从摄影检查12个元素的X光谱开始他的研究,其中10个元素在周期表占有依次相连的位置。他发现在各个元素的光谱中称为K线的特征频率与表示各个相连的元素在周期表中的位置的整数的平方成正比。就象Moseley评价它的那样,证据在于“在原子中有一个基本的量它按照从一个元素通向下一个元素的有规律的阶跃而增加。”这个在1920年首先被当时在剑桥大学的Ernest Rutherford称为原子序数的基本量,现在已被确定为原子核中的质子数。
Moseley的研究提供了可用来正确确定在周期表中留多少空位置的方法。有了这个发现以后,化学家们开始用原子序数代替原子量作为周期表的基
本排序原则。这一变化解决了元素排列中的许多悬而未决的问题。例如,当按照原子量排定碘与碲的次序(碘在前)时,就它们的化学特性而论,这两个元素被排定的位置显然是不正确的。但是,当按照原子序数排定次序时(碲在前),这两个元素就处在正确的位置上了。
了解原子
周期表不仅鼓舞了化学家进行研究,而且也鼓舞了原子物理学家努力了解原子结构。在剑桥大学工作的物理学家J. J. Thomson(他还发现了电子)于1904年开发了一个原子模型,充分注意到了元素的周期性。他提出特定元素的原子含有排列在同心圆圈上的特定数目的电子。而且,按照Thomson的看法,具有类似电子结构的元素将有类似的性质:因此,Thomson的研究为元素周期性提供了最早的物理学解释。虽然Thomson将电子的圆圈描绘为位于原子的主体内,而不是象今天所认为的那样环绕在原子核的周围,他的模型确实是人们提出原子中电子排列的第一次,是渗透到整个现代化学中的概念。
丹麦物理学家尼尔斯·波尔是将量子理论用于原子结构的第一个人,他也受到周期表中元素排列的启发。在波尔于1913年提出的原子模型中,电子处在环绕原子核的一系列同心层中。波尔推论,周期表同族元素最外层电子的结构可能相同,并且一个元素的化学性质主要取决于原子外层中电子的排列状况。波尔的原子模型也可用来解释为什么稀有气体缺乏反应能力:稀有气体具有充满电子的外层,这使它们异常稳定与不可能形成化合物。的确,大部分其它元素以形成化合物的方式,获得充满电子的外层。最近对波尔怎样获得这些电子结构的分析表明,他更象化学家而不象人们通常认为的那样是物理学家。波尔不是从量子理论中,而是从电子的化学与光谱学特性中推导出电子结构。
1924年,另一位物理学家,奥地利出生的Wolfgang Pauli开始解释周期表中各排或各个周期的长度。因此,他提出了泡利不相容原理,它表示两个电子不能正好以相同的量子态存在,这种量子态是以科学家们称为量子数的东西确定的。各个周期的长度取决于有关电子层填充顺序的试验数据与电子可以获得的4个量子数的量子力学限制情形。
Werner Heisenberg与Erwin Schrödinger本世纪20年代对量子理论的修正使量子力学基本上成为直到今天所用的这种形式。但是这些变化对周期表的影响是相当小的。尽管许多物理学家与化学家作了大量的工作,量子力学仍然不能对周期表作任何进一步的解释。例如它不能根据基本原理解释电子充填各电子层的次序。用量子力学不能推导出原子的电子结构,它是周期表现代知识的基础(这是因为量子力学的基本公式,即薛定锷公式不能够正确地解释除氢以外的原子)。所以量子力学只能通过使用数学近视法重现门捷列夫原来的发现一一但不能预测周期系统。
另辟蹊径
近来,研究人员提出了用于表示周期系统的不同方法。例如,蒙特利尔Ahuntsic学院的退休化学教授Fernando Dufour提出了一个三维的周期表,它不同于通用的普通二维周期表形式,可以表示周期律的基本对称性。同样的优点也可以在形状象金字塔的周期表中看到,此表在许多场合被提出过,
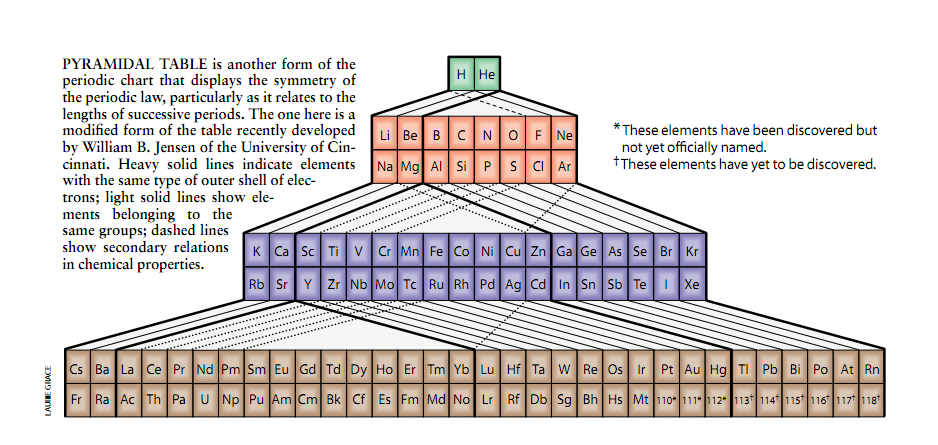
但是在最近才被辛辛那提大学Wi1liam B.Jensen改进。
另一个改变是旨在总结化合物性质而不是元素性质的周期系统的发明。1980年,田纳西州Co11egedale南方冒险家大学的Ray Hefferlin设计了一个头118个元素(到目前只发现了112个元素)之间能够形成的所有可能的双原子分子的周期表。
Hefferlin的周期表揭示了分子的某些性质——例如原子间的距离与使分子离子化所需要的能量一在常规条件下的表现。这个周期表能够使科学家们成功预测双原子分子的性质。
在类似的研究中,堪萨斯城密苏里大学的Jerry R. Dias设计了一类称为苯型芳香烃的有机分子的周期分类法。在卫生球中发现的化合物萘(C10H8)是最简单的例子。Dias的分类系统类似于元素的Döbereiner的三素组:任何一个三元组的中央分子的碳原子和氢原子的总和都为两侧分子碳氢原子之和的平均数,这对横向组与纵向组都适用。这一设计已被应用于苯型芳香烃性质的系统研究,随着图论的使用,已导致对某些此类化合物的稳定性与反应能力作出预测。
元素周期表仍然具有最广泛与最持久的影响。200多年来,许多人的努力使其逐渐演变,周期表仍然是化学研究的核心。它是现代科学中最富成果的思想之一,也许可以和达尔文的进化论相媲美。它与牛顿力学这样的理论不同,它并未被现代物理学所否定或彻底改变,而是逐渐适应和成熟,并且基本上未作多大改动。
【郑和平 译 冉隆华 校】
请 登录 发表评论