酒瘾开关
撰文 小约翰· I ·努恩贝格尔(John I. Nurnberger, Jr.)
劳拉·琼·贝鲁特(Laura Jean Bierut)
翻译 赵瑾
世界上有了酒,就有了贪杯的人。酗酒似乎还有着家族遗传的特征。在普通人眼里,这种遗传性不过是“近墨者黑”。但在科学家眼里,这种明显的遗传性却是一种暗示:是不是存在一种“酗酒基因”,才使得酗酒恶习世代相传?
过去10年间,生物技术迅猛发展,发现和分析基因的功能都不再是难事。研究人员可以利用先进的技术,找出“成瘾”背后的生物学机制。有了这些技术的帮助,研究人员既可以对一大群人进行遗传模式分析,也可以检查出个人基因组之间的几十万个细微差别,从而精确锁定某个特殊的基因——或强或弱地影响着个体生理机能,增加患病风险的基因。
正如其他疾病一样,酗酒不是由某一种原因造成的,遗传也绝不是一个人养成酗酒恶习的唯一根源。然而,基因却对习惯的养成举足轻重。在大脑及身体其他部位,无数生理过程时刻不停地进行着,它们相互作用、相互影响,甚至还会影响人们的生活,使有些人嗜酒如命,而另一些人滴酒不沾——这些生理过程都要受基因的“操控”。要理清基因与生理过程之间的联系,无疑是一项艰巨的任务。迄今为止,已发现的与酗酒有关的基因仅有十几个,但可以肯定的是,还有很多类似基因我们尚未发现。
我们所知道的每一个基因的突变体,都不会明显改变人们对待酒精的态度,但在很多人的身体内,都有这样的变异体,影响着我们的饮酒习惯,让我们深切留恋某种东西,使我们的行为也变得荒诞怪异,甚至抑郁低沉、烦躁焦虑。找出人体内的“酒瘾基因”,了解它的作用机制,也会帮助我们理解其他疾病的发病机制。究竟是哪些生理过程的“功劳”,让一些人逐渐“爱”上了酒精,最终不能自拔?找到答案,我们就能完善现有疗法,将他们从“酒缸”里拯救出来。
基因变异中的线索
科学家发现,一种基因变异让很多亚洲人不胜酒力,而在欧洲人体内就没有这种变异。但是,影响人们饮酒习惯的基因肯定不止一个,如何找到它们?由于基因会影响生理过程,科学家把注意力转移到了人体内的生理过程上。
基因强烈地影响着人体的生理机能,因为它们控制着十几万种蛋白质的合成。这些蛋白质要么直接影响身体和大脑的日常功能,要么调控其他基因的活性。自从发现第一个与酒精依赖性相关的基因,我们便坚信,人体基础生理机能的变化,与酗酒恶习的养成有着紧密的联系。
在中国、日本等东亚国家,很多人只要一喝含有酒精的饮料,就会满脸通红。几十年前,科学家就开始研究这一现象。科学家抽取了这些人的血液进行化验,结果显示,在这些人的血液中,乙醛(acetaldehyde)含量都比较高。酒精进入人体后,会被分解,乙醛正是分解产物之一,它会引起皮肤发热、心悸、体虚等症状,让人感觉不舒服。直到20世纪80年代,科学家才将这种反应与一种分解酒精的酶——乙醛脱氢酶(aldehyde dehydrogenase)联系起来,最终追寻到了编码这种酶的基因——ALDH1。乙醛脱氢酶能分解乙醛,但在受试者的ALDH1基因中,遗传密码出现了细微的变化,最后合成出的酶活性极低。因此,当这些人喝酒之后,乙醛就会在身体中累积,而高浓度的乙醛对身体是有害的。
在亚洲人群中,ALDH1基因发生变异是一种普遍现象,44%的日本人、53%的越南人、27%的韩国人,30%的中国人(其中有45%是汉族人)的体内都有这种变异,但在欧洲人的后裔中,这种变异却很罕见。正如我们所料,在ALDH1基因发生了变异的人群中,酒精代谢缓慢,很难养成酗酒的坏习惯(他们酗酒的几率,只有正常人的1/6左右)。这是基因变异让我们免受酗酒之苦的一个例子。
除了乙醛脱氢酶,科学家还研究了其他一些在酒精分解过程中发挥作用的酶,以了解它们在酒瘾形成过程中扮演的角色。比如乙醇脱氢酶(alcohol dehydrogenase,ADH),酒精转化为乙醛的第一步反应就是由这个酶来完成的。它是一个基因家族(由某一个祖先基因不断复制或发生某种改变而遗传下来的一组基因)的产物,家族中的每一个基因都能从不同方面影响乙醇脱氢酶的性质。其中,对酒精代谢最重要的基因是ADH1和ADH4。最近,一项以美国的欧洲后裔为对象的试验,为我们提供了有力证据:身体中带有ADH4基因突变体的欧洲后裔尤其容易养成酗酒的习惯。不过,ADH4基因突变体到底如何影响酒精代谢,还有待进一步研究。
酗酒具有非常复杂的遗传性,很可能有多个基因参与了这一过程。要“拼凑”出酗酒恶习逐渐形成的整个过程,就必须研究发生在这些基因之间,以及基因与环境之间的相互作用。同时,酗酒问题在人群中的表现形式也千差万别,特别是在这种倾向刚刚出现的时候,只是到了最后,每个“酒鬼”的表现才会很相似。因此,当科学家在研究酗酒的生物学机制时,必须明确定义“酗酒”,例如区分开真正的酒精依赖与酒精滥用。
根据一项诊断药物依赖性的精神病学标准,只有当一个人在过去12个月中,至少表现出以下症状中的3种,才能被诊断为依赖性成瘾:服用大量药物仍不会造成明显影响;停药后机体出现生理紊乱的现象;药物使用失控;试图停止或减少药物的摄入量;把大量时间耗费在某项活动上;不再参与其他活动;药物已经引起了生理或心理问题时,仍然继续用药。一个家族中,符合这些诊断标准的人要么没有,要么就不止一个。有了这些患者的自愿参与,我们和其他一些研究人员已经着手将他们每一个人的症状与生理原因联系起来,直至找出与症状相关的基因。
在寻找“酒瘾基因”时,一个重要的策略就是研究内在表型(endophenotype)。内在表型是一种物理性状,无法用肉眼观察到,但实验仪器可以检测到。内在表型比外部症状更容易揭示疾病的生理机制,因为这是一种基本的物理性状,它与疾病根源联系得更为紧密。因此,对内在表型的研究,可以监测病人的某些生理模式,将这些模式与患病风险联系起来。早在20世纪70年代,一些精神分裂症专家就提出了这种研究复杂行为的方法。借助近年来出现的先进设备,研究人员很容易监测生理过程和分析遗传数据,这种方法也因此变得更加有用。
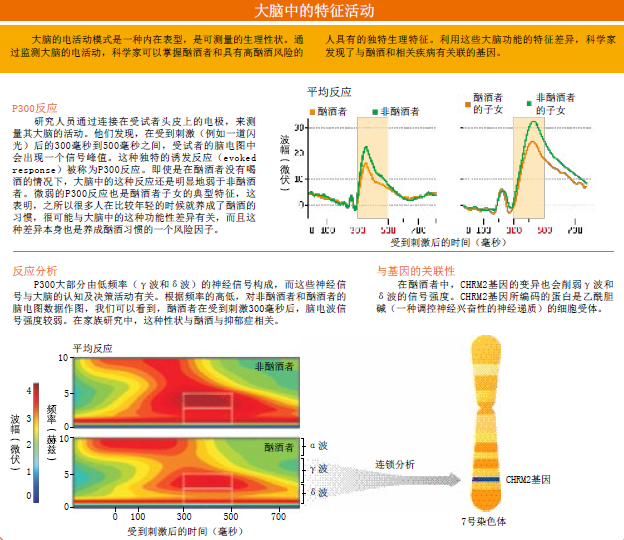
大脑的电活动模式就是一种内在表型。在病人头皮上连接电极,研究人员就可以利用脑电图(electroencephalography,EEG)技术,监测大脑的电活动,观察神经的放电模式。而计算机软件可以分析这些数据,大致确定是大脑中的哪些区域产生了上述信号,这样就有助于我们分析大脑中的认知过程。在脑电图中,我们可以看到,当某种刺激引起神经活动时,大脑中的总体波形(waveform)和峰值(spike)是因人而异的,所以可以将脑电图看成一种神经指纹图谱(neurological fingerprint)。这些神经活动模式也能反映大脑中各种兴奋过程与抑制过程之间的总体平衡(在兴奋过程中,神经元会更加迅速地对其他神经元发出的信号作出反应,而抑制过程则会降低神经元的反应性)。
这样的电生理模式具有高度遗传性,在酗酒者和正常人之间有着显著的差异。在酗酒者的大脑中,兴奋作用远远超过并且压制着抑制作用(去抑制作用)。在酗酒者的子女中,也能观察到这种不平衡性或去抑制作用,这说明酗酒者的后代也很可能会酗酒,同时也意味着电生理模式是遗传性酗酒的标志之一。此外,独特的电生理模式可能代表着对酒精的“天生爱好”。有科学家认为,负责判断和决策的大脑区域中抑制性神经细胞的普遍缺失,是去抑制作用产生的原因。缺少了这种抑制回路,人的行为可能更容易受到发自于大脑底部区域(如杏仁核,amygdala)的神经冲动的影响。
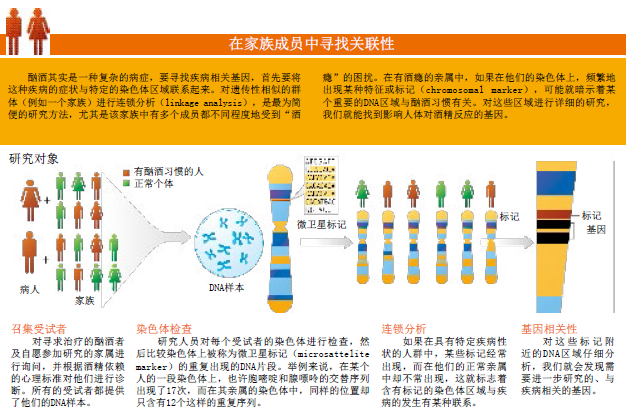
20世纪80年代,多个实验室的研究都证明,大脑的电活动能够揭示一个人会有多大的几率对酒精上瘾。这些实验证据让科学家意识到,寻找与酗酒相关的基因是可行的,而且具有实际意义。在美国国家酒精滥用及酗酒研究所(National Institute on Alcohol Abuse and Alcoholism)的支持下,酗酒遗传学合作研究项目(Collaborative Study on the Genetics of Alcoholism,缩写为COGA)于1989年启动了(本文的两位作者都参与了这项研究)。目前,美国有8个研究中心和几千名“酒精爱好者”及家人同意参与这项研究。
寻找酗酒基因
酗酒具有遗传特性。科学家根据某些遗传性状,最终在多个染色体上都找到了与饮酒习惯相关的基因,而且还将这些基因与相应的生理活动联系了起来。
在COGA启动初期,美国各地的研究人员开始寻找深受酗酒影响的家庭。在此前对双胞胎、领养的孩子以及某些家族进行研究时,科学家发现酗酒习惯与遗传有着紧密的联系:在影响酗酒习惯的因素中,遗传因素至少占了50%以上。也就是说,如果要追踪某些特定的性状,并将这些性状与相关基因联系起来,家族群体是一个重要的研究对象。
大约有1,200位因为对酒精有依赖性而寻求治疗的受试者及其亲属(总人数超过11,000人)接受了调查。科学家发现,其中262个家庭都属于“酒瘾家族”,也就是说在这些家庭中,3个或3个以上的一级亲属(例如父母或兄弟姐妹)也有酒瘾。这些家庭的每一位成员,不管是否酗酒,都接受了脑部电生理内在表型的检查,科学家还通过谈话,进一步了解他们的情况,以衡量其他与酗酒风险相关、受基因影响的特性。这些特性包括了“低反应”(即这个人必须摄取大于平均剂量的酒精才能感受到影响)、抑郁经历以及饮酒史(例如24小时内摄取酒精的最高剂量)。
这些受试者还提供了DNA样本,COGA的科学家可以检查每个人的染色体,找出不同的分子特征。这些分子特征可以作为标记:只要一看到它们,科学家就知道染色体上的某个区域具有重要研究价值。如果一些标记经常出现在“酗酒家庭”中,那个染色体区域就很可能与酗酒习惯存在某种联系。利用这种研究方法,科学家在1号、2号、4号和7号染色体上发现了类似的关联性,经过多年的基因定位研究,他们在那些区域相继鉴别出了几个特定基因,比如4号染色体上的ADH4和GABRA2基因,以及7号染色体上的CHRM2基因。其他研究小组对不同人群的研究也证明,酗酒习惯与某些染色体区域及基因有着千丝万缕的联系,进一步证实了基因在酒瘾形成过程中发挥的作用。
比如,在细胞表面,有一种专门与GABA(gamma-aminobutyric acid,γ-氨基丁酸,这是一种在神经元之间传递信号的蛋白)结合的蛋白质。越来越多的研究证据表明,编码这种蛋白的基因一旦发生变异,个体就很容易养成酗酒的习惯。在哺乳动物神经系统中,GABA是最常见的抑制性神经递质,能与细胞膜上的GABA特异性受体结合,抑制细胞对神经信号作出反应,从而调节神经元的活动。在GABA的受体中,有一类受体叫做GABAA,由多个蛋白质亚基构成。研究发现,其中一个亚基的基因强烈影响着一种被称为β波的脑电波内在表型,而这一表型似乎与神经细胞的去抑制作用有关。
在大脑的额叶皮质(frontal cortex)内,有很多神经细胞都带有GABA受体。如果额叶皮质的抑制作用完全丧失,癫痫(seizure)就会发作。医生们治疗癫痫的方法正是激发GABA的活性,发挥它的抑制作用。如果GABA所诱导的抑制作用只是部分丧失,则可能导致行为失控或极易冲动,这两种症状是许多精神障碍的特征,比如双相情感障碍(bipolar affective disorder)、药物滥用等。COGA联盟的成员进行的研究表明,GABRA2基因的突变与酗酒有关,后来,又有4个研究小组证实了这一发现。有趣的是,GABRA2基因的变异虽不会改变GABAA受体的结构,但似乎会减少相应蛋白亚基的合成量,从而减少功能性受体的总数。
虽然人们还在研究GABA受体基因的突变体影响大脑中去抑制作用的确切机制,但GABA活性与酒精依赖性之间的关联性肯定是有意义的,因为很多酒精依赖病人都非常容易冲动。这一性状尤其与早发型酒精成瘾相关,主要见于男性。有酒瘾的人一般容易产生外化性障碍(externalizing disorder,比如行为异常),与此相对的则是内化性障碍(internalizing disorder,例如焦虑症和抑郁症)。这样一来,即使不对病人进行遗传检查,只要知道了GABA在成瘾过程中的作用,也有助于我们开发具有针对性的疗法。
在对酗酒内在表型的研究中,另一种备受关注的神经递质就是乙酰胆碱(acetylcholine)。它与GABA一样,影响着中枢神经系统中的神经细胞。会对乙酰胆碱作出反应的神经细胞叫做胆碱能神经细胞(cholinergic neuron),在调控大脑中的兴奋与抑制作用之间的整体平衡方面,这类细胞起着重要作用。在检测了COGA受试者的大脑反应后,我们发现,酗酒与CHRM2基因所在的染色体区域有关。这一基因所编码的蛋白是一种特殊的胆碱能受体,叫做M2毒蕈碱型乙酰胆碱受体(M2 muscarinic acetylcholine receptor,CHRM2)。
CHRM2受体的激活会改变大脑中的慢β波和δ波,这些脑电波与认知功能(如决策和注意力)有关。我们还把CHRM2基因的突变体与酒精依赖和抑郁症的临床症状联系起来。与GABRA2一样,影响脑电活动、酗酒和抑郁症的CHRM2基因变异,似乎不会改变受体蛋白的结构,而是影响这些蛋白的合成。
这种特殊的关联性十分令人兴奋,因为它部分证实了美国范德比尔特大学(Vanderbilt University)的精神病学家戴维·亚诺夫斯基(David Janowsky)等人在1967年提出的假说。亚诺夫斯基认为,在大脑中不同的信号调控过程之间,必须保持一种精细的平衡,唯有这样,大脑才能正常运作。他的研究小组曾提出,在易患抑郁症和相关疾病的人群中,乙酰胆碱对毒蕈碱型乙酰胆碱受体的刺激效果增强了(超敏感性),这就是造成大脑中化学物质不平衡的根源。
最近发现的CHRM2基因与酗酒、抑郁症之间的关联性,第一次显示了特定基因与这种超敏感性之间的直接联系。这些有关胆碱能系统的发现,为我们提供了新的药物标靶,有利于研发出针对酗酒和抑郁症的特效药。我们也很想知道,为什么生理学上的细微差异能引起成瘾这样的复杂病症。
铲除酗酒恶习
酒精依赖性的形成有多种不同的途径,分别对应不同的生理基础。随着更多的基因与酒精依赖性的形成联系起来,我们可以更好地衡量个体的酗酒风险,开发个性化的治疗策略。
COGA项目虽然是以不同的家族为研究对象,但这项研究可以帮助我们了解在不同的种族之中,特定的基因变异体在酒精上瘾过程中的作用。这并不是说,某些种族更容易养成酗酒的习惯,而是说,就像ALDH1基因的突变体让很多东亚人远离酒精一样,某些容易引起酗酒的基因变异也会在某些种族中更为普遍。如果知道哪些基因在某一种族中更有可能导致酒瘾形成,在治疗病人的时候,医生就可以根据种族来推测他酗酒的成因,对症下药。
我们的研究小组最近发现,有一种基因(hTAS2R16)所编码的受体蛋白与味觉感受有关,与COGA受试者的酗酒行为也有着明显的联系。这种基因的变异会导致个体对多种苦味物质的敏感度下降。虽然这种变异在美国白人中不常见,却出现在大约45%的美国黑人体内,从而成为这个族群显著的酗酒风险因子。
目前已确认的与酒精依赖性相关的遗传因素,影响着人体内多个生理过程,从酒精代谢到大脑活动,以及我们刚刚提到的味觉感受。每一种基因所产生的影响不大,只是使平均风险提高大约20%~40%,还有其他尚未发现的基因可能影响着人们对待酒精的态度。
一个重要测试可以进一步确认和细化这些遗传发现:在某个人养成酗酒习惯之前,看这些基因变异是如何影响他的早期生活,以及基因变异能否预示酗酒习惯的形成。在研究中,COGA就采取了这样的前瞻性调查,监测酗酒高危家庭中年轻成员的成长。初步结果显示,如果青少年身上携带有ADH基因的突变体,也许在很小的时候,他们就会开始喝酒。随着时间的流逝,他们越来越离不开酒精。携带CHRM2基因突变体的人的情况就有所不同,他们在青少年阶段容易表现出抑郁症的早期症状,而非酗酒问题。GABRA2基因一旦发生突变,青少年就会变成一个问题少年:找警察的麻烦、和同学打架,甚至被学校开除,但他们一般不会提早喝酒。另一方面,在年轻人中,GABA受体基因的突变体确实与酒精依赖有关。
这些发现又一次揭示,酒精依赖性的形成有多种不同的途径,这些途径又有着不同的生理基础。ADH基因的突变或许是通过促使个体过量饮酒,而直接导致酗酒习惯的形成;而GABRA2基因突变则会使个体容易产生行为问题,而行为问题本身就是导致酗酒的一个风险因子。CHRM2基因会通过抑郁或其他内化性的症状,来促使酗酒习惯的形成。
随着更多的基因与酒精依赖性的形成相联系,我们可以更好地衡量个体的酗酒风险,确认治疗方法对哪一部分人的疗效更好。对于像高血压、癌症以及双相情感障碍这样的复杂病症,医生在开具药物和行为处方(behavioral prescription)的时候,通常会考虑病人的遗传特性(genetic profile)和其他家庭及环境的风险因子。目前,在根据基因变异决定酗酒治疗方案方面,临床医生还处于非常初级的阶段。我们希望在将来,会有更详尽的分子准则(molecular guideline),这样就可以帮助我们开发个性化的治疗策略。
吸烟和其他药物依赖问题也常发生在酗酒者身上,并且倾向于出现在有酗酒问题的家庭中。因而,与酗酒相关的遗传发现或许也可以改善对这些问题的预防和治疗。情绪障碍和焦虑障碍也是这样,CHRM2基因的变异与酗酒及抑郁症之间的关联性,也说明了这些问题可能在一定程度上有着共同的根源。因而,加深对酒精依赖性的认识,应该可以帮助我们分析相关病症的形成因素。
然而,遗传不能决定命运。对于一些基因变异的携带者来说,基因也许会与恶劣的成长环境(例如被虐待或忽视)相互作用,最终导致酗酒问题,但也有一些携带者却不会出现问题。如果酗酒风险一半是由遗传决定的,那另一半则肯定来自于其他因素。不会有人在没有作出任何错误决定的情况下,就变成一个酒鬼;只是在相同的环境中,有一些人会比其他人更容易受酒精影响。目前,科学家们正在研究这种现象的根源。
批评家们认为,从公共卫生的角度出发,对酒精依赖性和其他成瘾性(包括吸烟)的遗传学研究是不划算的。例如,有些人声称,全面限制致瘾性物质的使用才更加合理,而不是浪费大量的资源,毫无意义地找出哪些人会因为减少致瘾性物质的使用,而受到最大的影响。可以肯定地说,限制酒精、尼古丁和其他改变情绪的药物的使用,的确是有意义的。但是,帮助人们看清自己与酒精的距离,让他们能够作出明智的选择,过上健康的生活,这也是一件很有意义的事。
遗传测试已经让我们有机会对自身进行过去不可能进行的评估,而对于基因描述的需求也将越来越大。微阵列(microarray),也就是常说的基因芯片(gene chip),可以用来检测一个人的基因变异以及基因活性的变化,从而给予我们一系列医药、精神病学以及行为的建议。我们则可以根据自身的意愿,有选择性地采纳这些建议。科学知识转为实际应用肯定不可避免,在自由市场经济的大环境下,这样的转变将由市场驱动,并充满竞争。因此,学术界必须对这个过程加以引导,帮助人们区分基因与心理学联系的真伪,并鼓励社会对这些发现进行合理的应用。
1964年,美国公共卫生部部长的报告第一次公布了吸烟的危害。在此后的几十年间,吸烟泛滥的情况因为这份医学报告与它带来的社会压力得到改善。同样,个人对自身遗传风险因子的了解也会改变他们的选择。我们也许还不能很快看到这种新信息对于公共卫生和社会的广泛影响,但随着时间的推移,它们必将产生十分深远的影响。
请 登录 发表评论