我们为什么会长胖
撰文 杰弗里·S·弗莱尔(Jeffrey S. Flier)
埃莱夫塞里娅·马拉托斯-弗莱尔( Eleftheria Maratos-Flier)
翻译 杜珍辉
民以食为天,吃饭从来都是生活中的头等大事。远古时代,食物匮乏,人们过着吃了上顿没下顿的日子,为了能熬过食物匮乏期,人体必须在每次进餐后,把多余能量储存在身体的某个地方——脂肪组织出现了。
对于人类的生存来说,脂肪非常关键,它能让一个人在饥饿状态下存活好几个月。然而近几十年来,人们吃下的高能量食品越来越多,过剩的能量都被人体以脂肪的形式储存起来,导致许多人体内的脂肪组织数量一路飙升。如果体内储存的脂肪超过一定限度,开始危及身体健康,我们就称之为肥胖。
为什么越来越多的人变得肥胖?科技进步是原因之一。今天,我们不需要辛苦劳动就能吃好穿好,因为现代农业生产出了充足的食物。在这种情况下,人体内经常有剩余能量,脂肪也就越来越多。不过,在同样的生活环境中,有些人却要比其他人更容易变胖,这可能是因为生理机能的差异,这些机能会影响人体对脂肪的吸收、消耗和存储。
血压、体温、血糖及水分平衡状况等许多重要的身体参数,都受到自动调节系统的严密监控。但体重是否也受调节系统的控制呢?科学界一直没有定论。直到最近,科学家才有了突破性发现:调节系统中的一些细胞信号传导途径以及细胞活动,可能与脂肪储存量的调节有关。
对能量需求与储存的调控机制的了解,有助于科学家弄清楚遗传因素对调控机制的影响,也可以解答一个困扰科学家已久的难题:环境因素和过多的脂肪是如何使调控机制失效的?随着研究的深入,一个调控着脂肪积聚的复杂生理系统逐渐浮出水面,科学家也将据此开发出有效而健康的减肥方法。
体重稳定的背后
感知特定物质的浓度变化,并据此采取相应行动,将浓度控制在合理范围内,是所有生理调节系统都必须具备的能力。我们吃下食物后,消化系统会将食物的一部分转化为葡萄糖,进入血液循环,不断为各个组织的细胞提供能量。通常,葡萄糖浓度只能在很小的范围内波动。如果血糖浓度上升,胰岛中的某些细胞检测到这一变化后,就会分泌更多的胰岛素,加快肌肉和脂肪组织对葡萄糖的吸收和消耗。与此同时,肝组织也会作出响应,降低葡萄糖的生成量。
脂肪细胞会把多余能量转化成三酸甘油酯(triglyceride,一种脂肪酸,也称甘油三酯)。当食物供给不足,胰岛素浓度下降时,脂肪细胞就会向血液释放三酸甘油酯。当血液流经肝脏时,三酸甘油酯又会被分解成酮类物质,为肌肉和脑组织提供能量。
科学家在研究人类和动物时,一直都有这样的看法:在哺乳动物体内,很可能有一个调节机制,时刻监控着脂肪储存量,将它维持在特定水平。如果某个动物的体重一直很稳定,突然改变能量摄入量,就会导致它的生理和行为相应改变——这种改变正是为了保持体重。当动物的食物供给受到限制,它会减少活动量,减缓细胞利用能量的速率,从而降低能耗,避免体重下降太多。在此过程中,饥饿感会越来越强烈,一旦有了充足的食物,就会大吃特吃,直到体重恢复到以前的水平为止。相反,过量喂食会让动物的能量代谢指数上升、食欲降低,等到体重回落,这些症状才会消除。
如果没有体重调节系统,后果将不堪设想。就算吸收的能量只比消耗量多出1%,一位中等体型的人也会在30年内增加近30千克的体重。那么在人体内,到底有没有维持能量平衡的调节系统呢?答案是肯定的,虽然这个系统不够完善,但它的确存在。包括我们在内,很多研究小组都在鉴别组成能量调节系统的成员。
随着研究深入,有关能量调节系统的证据越来越多,然而我们从中得出的一个结论,却会让那些努力减肥的人感到失望:调控系统更“喜欢”储存脂肪,而不是减少脂肪,因为将多余能量转变为脂肪,是最经济有效的储能方式,对人类的生存具有重要意义。在漫长的进化过程中,人体内的相关基因甚至产生了一些突变,使人体能够更好地储存脂肪。
特定基因上的差异,则可解释一个奇怪的现象:有些人“喝水都会长胖”,另一些人食量不小,却没有丝毫长胖的迹象。最近,科学家对近4万人的基因组进行扫描时,一个叫做FTO的基因引起了他们的注意。FTO基因有多个突变体,都与肥胖紧密相关。研究发现,携带某种FTO基因突变体的人,体重比其他人平均重3千克,肥胖率也要高出一倍。FTO基因有什么功能,它如何使人们发胖,目前还没有找到答案。不过,从FTO与体重增加的相关性不难看出,这个基因可能参与了体重的调节过程。
当然,基因要发挥功能,还与环境有关。从进化的角度来说,过去几十年里,人类的基因不会发生什么变化,要知道为什么肥胖症会如此猖獗,先得从环境下手,弄清楚基因与环境之间的相互作用是怎样影响体重的。在现代社会,很多人的工作与体力劳动无关,也很少有时间参与体育锻炼,食物的丰盛程度却前所未有,这些因素都对人们的体重有着显著影响。不过,环境中更多的影响因素尚不明显。比如,胎儿发育时期摄入的营养素,对日后体重是否有影响;紧张、失眠、病毒感染以及体内的益生菌群的组成,是否会影响人体的脂肪调控过程,这些都有待进一步研究。
在寻找脂肪调控体系相关基因的过程中,科学家可以“顺便”阐明调控体系的一些基本运作机制。在跟踪相关基因编码的蛋白信号时,经常会发现,信号的目的地正是人体生理活动的“指挥中心”——大脑。
瘦素:关键的调控分子
几乎人体内的所有生理过程都受大脑的监控和影响,因此我们可以推测,大脑可能通过影响食欲、 生理活动以及能量分配来调节体重。
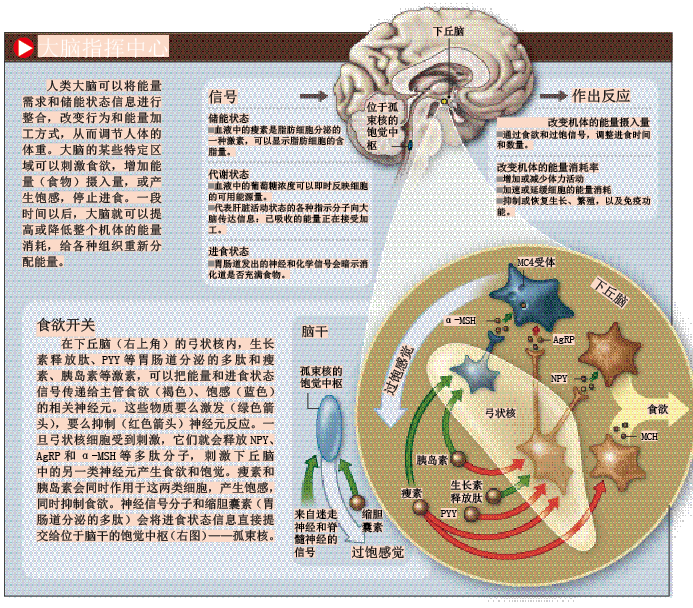
实际上,科学家在很多年前就发现,位于大脑基部的下丘脑(hypothalamus)是一个能量调控中心。在动物实验中,即使下丘脑只有轻微的创伤,也会导致动物发胖或变瘦(具体情况要视创伤的具体位置而定)。由于上述研究结果,科学家开始以“饱觉中枢”或“摄食中枢”称呼下丘脑的某些区域。
通过刺激食欲或感知进食量,大脑能直接调节人体的能量平衡。如果脂肪存储过慢、能量必须储存起来用于生存时,大脑会发出信号,抑制一些“无关紧要”的生理活动,比如生长和繁殖。不过,要想根据身体需要严格调控这些生理活动,大脑必须时刻关注人体内的能量储存情况。
大脑发出的是什么信号,这种信号又是如何抑制生理活动的呢?在血液中,很多化学分子的浓度一旦发生变化,就会影响到我们的食欲,比如葡萄糖等食物分解产物、胰岛素、缩胆囊素(cholecystokinin)等胃肠道分泌的激素。但能决定能量储存量的关键调控分子,却始终在与科学家“捉迷藏”。直到1994年,美国洛克菲勒大学的杰弗里·弗里德曼(Jeffrey Friedman)及其同事发现了瘦素(leptin),似乎才真相大白。
几十年前,美国缅因州的杰克逊实验室培育出了一种小鼠,它们食欲旺盛、能量消耗率低,患上了自发性重度肥胖症。由于小鼠的肥胖特征遗传自“父母”双方,因此科学家把它们叫做ob/ob小鼠(ob即英语中肥胖的缩写)。ob/ob小鼠的诞生,让科学家们如获至宝,成百上千个团队开始研究它们,试图找出这些小鼠的肥胖根源。弗里德曼首先发现了与肥胖相关的突变基因。这个基因在正常小鼠的脂肪细胞中非常活跃,不停地合成一种功能性蛋白质,而在 ob突变型小鼠中,却没有发现这种蛋白质——肥胖的发生似乎与这类蛋白的缺失有关。
科学家把希腊语中的leptos与英文中的thin(两个单词都是“瘦”的意思)组合起来,创造出一个新单词leptin(瘦素),来为这个新发现的蛋白质命名。有关肥胖与瘦素关系的推测,很快就得到了证实。只要每天给肥胖小鼠注射瘦素,它们的食欲就会降低、能量消耗量开始增加,“身材”也逐渐苗条起来。紧接着,另外一些科学家开始在早发性重度肥胖症病人身上进行试验——在这类病人身上,编码瘦素的人体基因发生了突变,无法合成瘦素。给他们注射了瘦素以后,得到了与小鼠试验一样的结果。
这些试验首次表明,脂肪细胞会合成激素信号,向大脑反映能量储存情况——三酸甘油酯含量越高,产生的瘦素就越多。大脑捕捉到这种信号,就会立即调节食欲和能量消耗率。相反,不论是因为基因突变,脂肪细胞无法产生瘦素,还是机体的脂肪储量不足,确实需要补充能量,只要没有探测到瘦素,大脑就会认为机体处于饥饿状态,并产生饥饿感,促进能量的储存。
瘦素的发现无异于一个突破口,让科学家有机会看清整个能量调节体系的“脉络”。很明显,脂肪细胞向血液分泌瘦素,主要目的是向大脑“通报”能量储存情况,让它及时作出相应的调整。追踪瘦素,就能找到与能量调节有关的神经通路和细胞。不出所料,下丘脑正是这些神经通路和细胞的“大本营”(参见第29页插图)。
在下丘脑的弓状核(arcuate nucleus)中,瘦素会同时作用于两个相邻的神经元群,它们以相反的方式调控食欲。其中一个神经元群会合成α—MSH多肽(α-促黑素细胞激素),抑制我们的食欲,使体重减轻;另一群则合成NPY和AgRP两种神经肽,刺激食欲,增加脂肪储存量。瘦素与这两群神经元的反应是非常精巧的过程。合成MSH多肽的神经元,会与携带有MC4受体的神经元连接,后者的激活可以产生抑制食欲、减轻体重的效果。刺激食欲的AgRP恰好能抑制MC4受体,阻止它被MSH多肽激活。因此瘦素要想成功激活MC4受体,必须提高MSH多肽的合成量,又得抑制NPY和AgRP的活性。
同时,瘦素还会以一种很有意思的方式,作用于大脑的“摄食中枢”(下丘脑外侧区),这个区域的某些细胞会分泌MCH激素(黑色素聚集激素)。1996年,我们发现在肥胖症小鼠体内,MCH的浓度明显偏高,这说明在正常情况下,瘦素可能会抑制MCH的合成。我们还推测,MCH浓度的上升会使动物吃下更多的食物,加重肥胖程度。另一个发现证实了我们的推测:如果肥胖症小鼠丧失了合成MCH的能力,它们很快就会瘦下来。这些发现让我们依稀看见了能量调控系统的真面目:脂肪细胞根据脂肪存储量分泌瘦素,瘦素作为能量信号作用于下丘脑,调节特定神经肽和激素的合成量,最后由神经肽和激素调控食欲和能量平衡。
受到瘦素调控的细胞和神经通路,还受到不少其他因素的影响。下丘脑和相关脑区把接收到的各种信息加工整理后,形成一幅实时反映体内能量状况的“监控图”,然后根据图上的变化情况随时反应。为了进一步破译瘦素等分子传递给大脑的信号,科学家需要寻找这些分子的本源。
来自胃肠道的神经信号
鼓鼓的肚皮是非常明显的信号,表示我们刚刚吃过东西,吃得太多所引起的胃扩张会导致食欲降低。要把这种生理状况传达给大脑,可以借助胃肠道的扩张敏感性神经纤维来实现。胃和小肠发出的信号会沿着神经纤维直抵食欲控制中心。反映肝脏能量代谢状况的神经信号,也会通过迷走神经(vagus nerve)向大脑传递。
胰岛素也可直接作用于下丘脑的神经元,来抑制食欲。每当我们吃完饭,肠道还会释放另外几种激素,由血液循环到达大脑,发挥抑制食欲的功效。缩胆囊素是最重要的一种激素,它可以产生暂时的饱腹感,不过作用有限,无法让我们停止进食;与缩胆囊素具有相似功能的,还有小肠分泌的PYY 多肽(酪酪肽),生长素释放肽(ghrelin)则是目前发现的唯一能刺激食欲的多肽,在吃饭前由胃部分泌,可能起着催促我们进食的作用。(参见第30页框图)。
上述信号分子的“有效期”虽然很短,但它们会向大脑传达食物已被消耗,或即将被消耗的信息。在肥胖症患者身上,这类分子的合成很不正常,直接导致大脑的能量调节机制作出错误决定。当一个肥胖的人下决心减肥,刚刚有点成效时,体内生长素释放肽的合成量就会大幅增加,产生强烈的饥饿感,促使他尽快进食。
从长远效果来看,脂肪本身发出的信号可能也与能量调控失衡有关。多年以来,脂肪一直被看作是被动的“储能仓库”,在机体需要的时候,以脂肪酸的形式释放能量。瘦素被发现后,科学家才认识到了脂肪的另一个身份——内分泌腺,它的活动会对机体健康产生广泛的影响(参见第33页框图)。
目前,在脂肪分泌的激素中(统称脂肪因子),只有瘦素被确定参与了脂肪存储量的调节,其他分子是否有这样的功能还有待研究。脂联素(Adiponectin)是由血液中的脂肪细胞分泌的激素,在肥胖症患者体内,它的浓度低于正常水平。如果实验小鼠缺乏脂联素,将会变得非常肥胖;也有研究表明,在某些情况下,脂联素有刺激食欲的作用。虽然这些研究处于起步阶段,但脂联素很可能也是脂肪细胞分泌的信号分子,负责向大脑传递能量需求信息。果真如此,脂联素也许就能抵消瘦素抑制食欲的作用。

肥胖源于基因突变
能量调节体系是一个极其复杂的生理网络,还有很多信号分子和神经通路尚未发现,调节体系中出现的故障如何让人发胖,也没有完全研究清楚。根据瘦素的功能,我们推测,少数重度肥胖症患者可能缺失了某个基因。这种“单基因肥胖症”十分罕见,具有重要的研究价值。在我们已经发现的这类病人中,有些病人是因为编码瘦素或瘦素受体的基因发生了突变,还有些人是因为编码MSH多肽前体的基因发生了突变。
编码MSH的受体——MC4受体的基因发生了突变,丧失了功能,也会引发重度肥胖症,这类病人占肥胖症患者的3%~5%。MC4受体的基因一般有两个拷贝,发生突变的只会是其中一个,因此在这类肥胖症病人中,MC4受体的功能只有正常人的一半。
遗憾的是,大多数肥胖症患者的症状,都不是由已知的基因突变引起的。有些发现甚至与我们先前的认识截然相反。我们曾推测,瘦素可以抑制食欲、减轻体重,却惊奇地发现,肥胖症患者体内的瘦素浓度比瘦人的要高。不过,这并不能说明先前的认识是错的,真相很可能是肥胖患者对瘦素产生了耐受性:由于某种原因,能量调节体系没有接收到瘦素传递的能量过多的信号。这一假说得到了临床试验的证实。某些肥胖症患者明显缺失了与瘦素相关的基因突变,但给他们注射瘦素后,医生并未得到预期的疗效。
瘦素耐受性的分子机制成了科学家新的研究焦点。两种蛋白质很可能与此相关,它们发挥作用的地点是在大脑和外周组织。一种是由瘦素信号“接收器 ”——下丘脑神经元合成的,叫做SOCS3,能阻止瘦素向神经元传递信号;另一种是PTP1B,可以在神经元内部直接“掐灭”瘦素信号。小鼠试验表明,只要降低SOCS3或PTP1B在组织或神经元中的浓度,就能增强小鼠对瘦素的敏感性,从而抵御肥胖。虽然上述两种蛋白的确切功能还不清楚,但是根据小鼠试验,我们可以大胆猜测:瘦素敏感性神经元合成这两种蛋白分子,很可能是用于调节瘦素信号的强度,以免瘦素浓度过高时,受到太大的压力。在肥胖症患者体内,瘦素浓度长期偏高,神经元为了确保自身安全,开始大量合成SOCS3和 PTP1B,导致肥胖症患者对瘦素产生耐受性。
这些反馈机制让病人越来越胖,而参与能量调控的基因发生的突变,也有类似的作用。我们相信这些基因突变会影响体重,让我们更容易变胖,但其中的具体机制还不得而知。一般说来,基因突变影响体重的方式有两种:多个基因都发生突变,但每个突变作用有限,对体重的影响依靠“团队作用”;只有几个重要基因发生突变,它们会影响大多数人的体重——哪一种方式的影响更大还有待进一步研究。基因扫描技术的广泛运用,大大加速了对新的体重调控通路的研究。不过,面对肥胖症及其相关并发症在全球蔓延的趋势,我们至今仍缺乏有效解决办法。
减肥药的安全问题
对于肥胖病人来说,减少食量、改变饮食结构、多锻炼等简单方法,很适合急于减肥的人。虽然保持减肥效果并非易事,但只要坚持,这些方法可以帮助他们减少10%的体重。
目前,每年有几十万患者接受减肥手术。这些手术要么是将胃捆扎起来,减少胃容量;要么是改造胃肠道——缩小胃囊、绕开部分小肠(胃绕道手术,gastric bypass)。相对于药物治疗,手术减肥的优势十分明显:效果立竿见影,而且不易反弹。最近有研究表明,接受胃绕道手术的病人食欲会下降,原因可能是PYY、生长素释放肽等胃肠道激素的浓度发生了改变。如果我们能找到具有同样功效的药物,手术减肥“一统天下”的局面势必会被打破。
任何减肥新药都必须满足3个条件:安全、有效、病人不容易产生耐受性。科学家开发减肥药时面临的最大难题是,能量调控体系对其他生理活动有着非常重要的影响,轻易改变这些通路,很可能引发连锁反应。因此,减肥药物要达到上述标准,并不容易。以前也曾有过非常有效的减肥药,但经过长期观察后,人们发现这些减肥药不仅会让病人上瘾,还有很严重的安全问题。有了前车之鉴,药品管理机构对减肥药的审批非常严格。一种合格的减肥药物除了要有减肥功效,对肥胖症的并发症,比如糖尿病、高血压等,也得有治疗效果,至少不能加重病情。由于肥胖症患者只有坚持服用药物,才不会让体重反弹,因此任何减肥药物必须保证在长期服用的情况下,不会产生任何毒副作用。在减肥药的使用上,还有一个问题不得不提:有些人为了追求完美身材,可能会滥用减肥药。
最近,在欧洲已经上市的减肥新药利莫那班(rimonabant),由于可能导致抑郁症和焦虑症,未能获得美国食品及药品管理局(FDA)的批准。这种药物的工作机理是,抑制大脑和外周组织中的细胞表面受体CB1的活性。CB1除了能让人在吸食大麻时产生饥饿感外,还能协调各个组织中脂肪分子的活动。长期服用这类药物时,如何做到安全有效,我们现在还不是很清楚。
目前,FDA只批准了两种能用于长期治疗肥胖症的处方药进入市场。西布曲明(sibutramine)在1997年获得批准,它能延长大脑中的神经元与去甲肾上腺素、5-羟色胺等神经递质的接触时间,进而降低食欲、减轻体重。但服用这种药物会导致血压升高、心率加快,因此只能限量使用。1999年,奥利司他(orlistat)也通过了FDA认证。它以降低胃肠道脂肪吸收量的方式,减少人体吸收的总热量,从而适度减轻体重,缓解肥胖相关并发症。目前,这类非处方药以“Alli”为商标正式进入市场。
最近几年,根据新发现的调节食欲与体重的生理机制,科学家开始研究新型减肥药。 MCH、NPY 以及生长素释放肽能刺激食欲,抑制它们活性的药物,就有可能成为减肥药。还有与抑制食欲的PYY类似的药物、MC4和5-羟色胺受体的激活剂也可能成为未来的减肥药。这几类潜在药物与现有的减肥药有着相似的作用机制:降低机体的能量摄入量。由于体内脂肪减少后,机体会转入“储能模式”,因此还有必要在药物中添加适量的辅助成分,提高人体的能量消耗率。
有几个研究小组则基于完全不同的机制设计减肥药。他们的想法是,用药物提高细胞释放能量的速率,或阻断细胞的能量储存过程,从而达到减肥的目的。一种具有代表性的方法是,激活β3-肾上腺素受体和PPAR核受体,诱导组织释放解偶联蛋白-1(uncoupling protein 1)。解偶联蛋白—1是一种能量需求信号,脂肪细胞接收到信号后,就会向血液释放三酸甘油酯。不过,这种技术可能只对褐色脂肪有效,目前只在啮齿动物和新生儿体内发现了这类脂肪,成年人体内则几乎没有。
抑制与脂肪储存有关的酶的活性,也是一种研制减肥药的方法。在脂肪细胞和肝细胞内,氢化的可松一般处于休眠状态,但它们可以被11β-羟化类固醇脱氢酶-1(11bHSD1)激活。氢化的可松恢复生物活性后,会促使细胞制造更多的甘油三酯。我们发现,如果小鼠的脂肪细胞合成过多的11bHSD1,细胞内的糖皮质激素(corticosterone)浓度就会升高,引发肥胖症,甚至出现糖尿病、高血压、高血脂等并发症。相反,如果11bHSD1的活性被抑制,小鼠就可以免受肥胖之苦。
虽然科学家还没有找到确凿证据,证明11bHSD1与肥胖症有关,但11bHSD1的抑制剂已经找到,有望用于治疗代谢综合症(metabolic syndrome)。希望有一天,在对付肥胖症的时候,它也能派上用场。
很多专家都认为,药物减肥最终会涉及多种药物的联合使用,让它们在多种生理途径上同时发挥功效,而且还可以针对不同的病人使用不同的药物,就像我们今天用药物治疗糖尿病、高血压那样。当然,最好的减肥方法还是改变饮食结构和生活方式,不过如果这种方案失败,反而加重了病人的病情,那么选择安全药物治疗将会是明智之举。
请 登录 发表评论