进化史上的证据
在Smurf家族有两兄弟,Smurf1和 Smurf2,它们同源性很高,达到了80%。两兄弟中,Smurf1和骨有关,工作是剪切生成骨基质的Smad蛋白;而Smurf2看起来像是个肿瘤抑制基因,如果敲除小鼠中的Smurf2基因,衰老以后的小鼠就会自发长肿瘤。那么,CKIP-1会不会同时调节两兄弟?那样的话,阻止CKIP-1的表达就很可能会带来负面效应了。
然而,细胞水平的实验结果令人欣喜,CKIP-1具有很强的特异性,它只激活Smurf1的活性,但并不影响Smurf2的活性。“这一点给了我们很大的激励,”张令强说:“我们想,CKIP-1很可能是Smurf1的一个特异的辅助因子。”
查看CKIP-1的进化历史,科研人员也找到了很多有利的证据,Smurf早在果蝇体内就出现了,但那时候Smurf家族只有1个成员;而CKIP-1基因最早出现在硬骨鱼中,在较晚出现的青、三刺鱼和红鳍东方3种硬骨鱼中还分别出现了一次扩增。这是否意味着该基因是随着骨骼的进化而出现的呢?
再追溯Smurf家族的进化历程,我们可以发现,当CKIP-1出现的时候,Smurf由一个变成两个。“之所以会一分为二,是因为它们的存在都是有必要性的,分别承担了不同的任务,要分化出来。”张令强说:“它们可能有功能上的冗余,但也会有各自功能上的独立性,Smurf1的独立性在于它能够调节骨,CKIP-1出现就是为了帮它一起工作,那么,这个辅助因子是不会跟Smurf2结合的。”
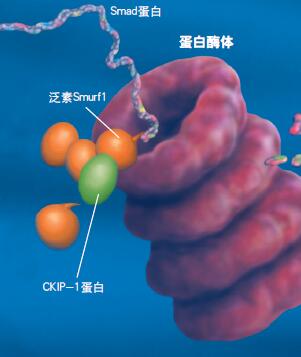
图. 泛素化降解的过程
CKIP-1起激活Smurf1的作用,作为泛素连接酶,Smurf1指认出Smad蛋白并结合其他泛素将Smad蛋白送入蛋白酶体。接着,Smad蛋白被降解成氨基酸。而Smad蛋白对促进骨形成起关键作用,细胞内的Smad蛋白少了,不利于骨形成。如从源头控制CKIP-1基因表达就能有效防止Smad蛋白减少。
递送系统,靶向精准
有了实验和进化的双重证据,张令强和他的同事们就可以实现自己的理想了:“今年在《自然·医学》(Nature Medicine)上发表文章,就是想把纯基础的研究,往转化医学推进,第一步就是想通过基因沉默技术对骨量进行调节,如果可能,或许就会实现对骨质疏松的治疗。”
众所周知,基因的功能是编码蛋白质,而蛋白质是所有生命活动的基础。从基因到蛋白质有一段很长的路要走:转录、翻译、修饰,这之间存在着很大的可供调控空间。20世纪90年代,科学家在研究RNA的过程中发现,人体细胞中还存在大量不产生蛋白质的小分子干扰RNA(siRNA),这种小分子单链RNA通常由20〜25个核苷酸组成,它们可以和体内的一些酶结合,形成RNA诱导的沉默复合物(RISC),它们和siRNA一起,在细胞内寻找由基因转录而来的与之同源的信使RNA(mRNA)。一旦发现目标,siRNA就会与mRNA碱基互补配对,跟随siRNA的一种核酸内切酶将切断mRNA,阻断mRNA的表达,破坏相应蛋白质的产生。那么,如果人为地模拟这个过程,就可以影响基因的表达。
“2006年,RNA干扰被授予诺贝尔生理学或医学奖,从发现到获奖,此项技术只用了短短10年时间,由此可见,它的科学价值和应用前景是科学界公认的。”张令强介绍:“要利用此项技术治疗骨质疏松,需要具备两个条件,首先是通过RNA干扰,实现对一个基因或者一个蛋白的特异性调低沉默;第二就是要把这个siRNA递送到成骨细胞环境里去,比如我们不希望它到心脏,不希望它到神经系统,也不希望它到免疫系统,否则的话,它可能对其他组织器官造成损害。”
香港中文大学矫形外科及创伤学系张戈教授团队、中国科学院深圳先进技术研究院转化医学中心秦岭教授团队以及香港浸会大学中医药学院杨智钧教授团队,在骨、材料学和siRNA的包裹等方面有很好的基础,他们和张令强团队合作,共同完成了这项任务。
在研究递送系统的过程中,他们发现了一篇论文,文章提供了一个对成骨细胞识别的寡肽序列,由18个氨基酸组成,其中包含6组天冬氨酸、丝氨酸、丝氨酸(DSS6)。它对成骨细胞有一种高亲和力,可以被特异地富集到成骨细胞。反过来,如果是8个天冬氨酸(D8)组成的寡肽,就可以富集到破骨细胞。“这个寡肽可以作为一个靶头,用它来进行导引,后边可以用聚乙二醇连接一个脂质体。”张令强说:“在骨组织中,有多种细胞,我们只是希望siRNA能够特定地被富集到成骨细胞周围,而破骨细胞的区域,我们希望它去得少一点,这样才能实现特异化的进程。”
脂质体的作用是包裹siRNA,其成分是模拟人体的细胞膜结构的磷脂双层分子。乔装打扮的脂质体,进入生物体内,先是跟细胞膜打个照面,曲意迎合它们,并声称“我是自己人,安心地放我过去吧”。然后,便巧妙地混进细胞膜的队伍,再在细胞膜上打开一个通道,就可以把siRNA运到细胞里了。
进入细胞的脂质体,亮出“致命武器”siRNA。接着,siRNA就会在细胞质里寻找与它互补的碱基序列,即CKIP-1基因的mRNA,与它结合并促进其降解,从而阻止了携带CKIP-1信息的蛋白质的合成。靶头、脂质体和siRNA配合作业,一个寻找成骨细胞,一个骗过细胞膜,一个降解mRNA,最终实现了阻断通路的效应。
有了工具,张令强和他的同事们开始尝试着把siRNA治疗技术引入实验,他们首先把雌性大鼠的卵巢切掉,模拟绝经。4周后,大鼠的骨量显著下降,通过影像学测骨的三维结构,他们发现大鼠的骨出现了明显的疏松现象。这时,给这些大鼠注射siRNA注射液,9周以后,大鼠的骨量有了很明显的回升,到第12周时,大鼠的骨量已经回到卵巢切除前的水平。
张令强向记者介绍:“CKIP-1蛋白有409个氨基酸和1200多个核苷酸编码,从中可以找到很多靶位。在设计之初,我们就选择了在小鼠、大鼠、猴和人都保有的、序列相似的靶位,筛选出有效的siRNA,便于将来用于不同物种的实验,这样就可以避免动物实验的效果无法在人体实现的情况。”
(本文发表于《科学世界》2012年第7期)
请 登录 发表评论