众所周知,吃饭时,口腔会自然而然地分泌唾液,而且咀嚼的时间越长,米饭的甜味越明显,这是由于消化食物等的淀粉酶开始工作的缘故。
米饭的主要成分是淀粉,淀粉则是由几万个葡萄糖分子聚合而成的长链分子。淀粉酶可以切断淀粉的长链分子。淀粉在口腔中不能充分消化,大部分的淀粉分子都被“囫囵吞枣”地吞入腹中,只有一小部分被分解为短的糖分子(麦芽糖),因此,咀嚼时能微微感到甜味。吞入腹中的淀粉分子则在十二指肠中被胰液中的淀粉酶进一步分解消化。
没有酶,食物就不会腐烂!
为什么淀粉酶不可缺少?众所周知,葡萄糖是细胞的主要能量来源。葡萄糖可以进入人体细胞的内部,氧化分解后释放出能量,但是,淀粉却无法进入细胞内,因此需要先切割淀粉,将其转换成葡萄糖。
在无酶情况下,切断米饭分子的化学反应几乎不会自然地发生。不过,如果加入了酶,则能极大地加快反应速度,1个酶1秒钟内可催化一千多次反应。
就这样,酶通过切断食物的分子,使其能够为人体所吸收,这个过程称为“消化”。我们能否吃某种食物,其实取决于体内是否存在能消化这种食物的酶。例如,人体无法消化纸张,但是羊等草食动物却能消化,这是因为它们体内含有能够分解纸分子(纤维素)的酶。我们知道,剩饭放置不管的话很快就会腐烂,这也是细菌等的分解酶“辛勤工作”的结果。腐烂是指在细菌的酶分解食物的过程中产生了有害物质。在无菌状态下,食物不管放置多久都不会腐烂。
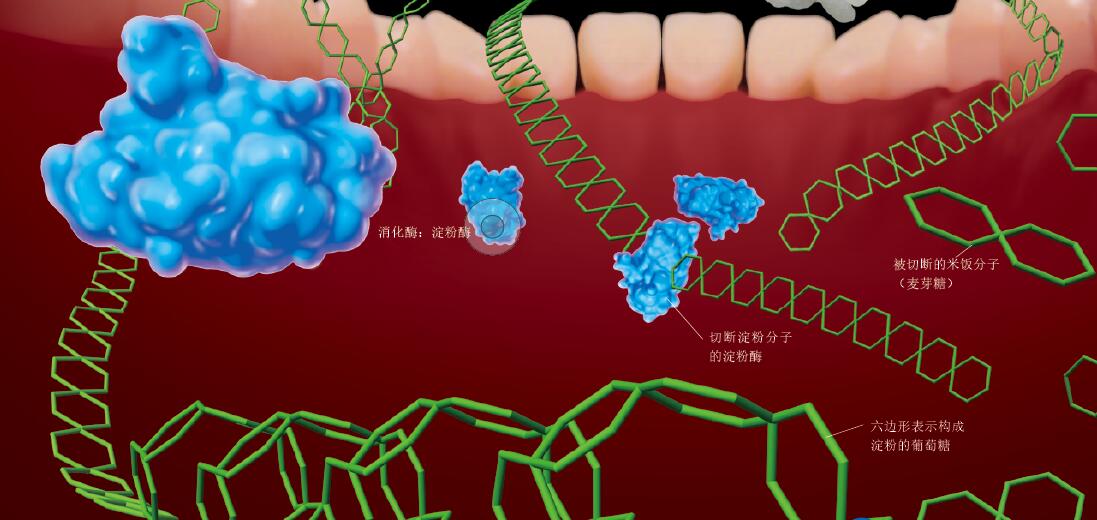
图1. 淀粉酶切断米饭分子
唾液中的淀粉酶对切断米饭分子的化学反应具有催化作用。淀粉酶吸附在由多个葡萄糖结合成的长链淀粉分子上,从而切断葡萄糖之间的结合。葡萄糖之间的结合被切断后,酶就从分子上脱离,再次附在淀粉分子的其他部位,然后再次切断葡萄糖之间的结合。这一过程周而复始,于是,长链分子就被剪短了。未被唾液中的淀粉酶分解的部分最终在十二指肠中被胰腺分泌的胰液中的淀粉酶继续分解,最终被分解为麦芽糖(由2个葡萄糖分子结合而成的二糖)。麦芽糖则被另外的酶分解为葡萄糖,可用作细胞活动的能量来源。
为什么人体不会被消化酶分解?
我们知道,每种酶的形状只是略有不同,可是,它们的性能和作用却大不相同。因此,人体巧妙地利用酶的特异性而对其功能进行调节,有时不让其发挥作用,而有需要的时候则又让其发挥作用。
蛋白质是人体必需的重要营养成分之一。要想消化蛋白质,首先需要借助于酶将其剪切成小片段。不过,蛋白质也是组成人体细胞的基础物质。如果在细胞内合成剪切蛋白质的酶的话,这种酶也可能会是一个威力巨大的“毒药”,甚至把人体自身分解掉。
为了防止人体“自我毁灭”,因此在细胞内合成了胃蛋白酶原(一种蛋白质)。胃蛋白酶原是胃蛋白酶的前体,比胃蛋白酶(能分解蛋白质)多44个氨基酸。由于这个多余的部分堵在引发化学反应的部位(活性部位),所以胃蛋白酶原不能切断蛋白质。
众所周知,胃腔中有酸性非常强的胃酸(pH2)。食物中的蛋白质进入胃后,分泌入胃腔内的胃蛋白酶原在胃酸的作用下,分离出堵在活性部位的多余部分,转变为具有活性的胃蛋白酶,开始迅速分解食物中的蛋白质。此外,胃壁上覆盖着一层厚厚的黏膜(由黏蛋白构成),可以保护胃,免受胃酸和胃蛋白酶的伤害。
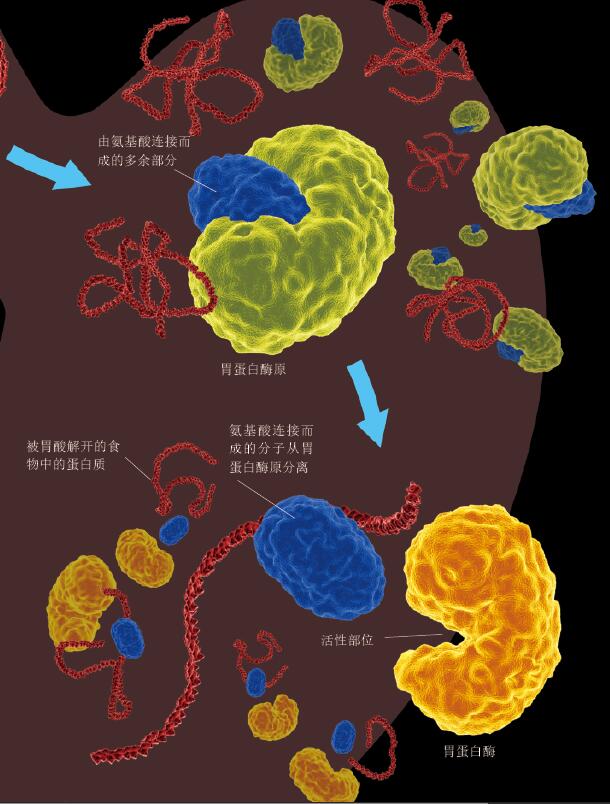
图2. 胃蛋白酶只在胃中具有活性的机制
虽然酶是在细胞内生成的,但是在细胞内生成能切断蛋白质的酶却是一件极其危险的事情,因此,细胞内首先生成了胃蛋白酶原。胃蛋白酶原由于带有1个由氨基酸连接而成的多余部分,因此不具有活性,不能分解蛋白质。食物进入胃腔后,分泌入胃腔中的胃蛋白酶原在酸性非常强的胃酸(pH2)的作用下,分离出多余的分子,转化为胃蛋白酶。胃蛋白酶具有活性,能够切断蛋白质。胃酸不仅能把胃蛋白酶原激活为胃蛋白酶,还能解开食物中蛋白质的盘曲折叠的长分子链,使其容易与胃蛋白酶结合,甚至能杀死食物中的微生物。此外,胃壁上覆盖着一层厚厚的黏膜,可保护胃免受伤害。
胃部的分解工作结束后,蛋白质被剪切成小的肽片段,与胃蛋白酶一起进入小肠内。那么,胃蛋白酶会对小肠造成伤害吗?
由于酶的形状会随着温度、酸度及压力的变化而发生微妙变化,因此每种酶都有自己的最适温度、酸度和压力。胃蛋白酶只有在酸性较强的环境中才具有高活性,最适pH为2,且活性随着pH的升高而降低。小肠内为弱碱性环境(pH7.5~8),胃蛋白酶在这里几乎没有活性,因此肠道不会被胃蛋白酶分解。肽在小肠内被羧肽酶A等酶分解为氨基酸。羧肽酶A不能分解长链分子(蛋白质),因此不会对小肠造成伤害。
就这样,人体借助酸度差或让酶携带多余部分等方式,巧妙地控制着酶的活性。
(本文发表于《科学世界》2016年第4期)
请 登录 发表评论