有时用空调或电暖炉取暖,有时因为淋雨而感到寒冷,每天我们都在和热打交道。但是,热却看不见摸不着。
温度是“运动的剧烈程度”
我们知道,不管什么物体,都是由原子或分子这些微小的粒子所构成的。那么,当物体的温度改变时,构成这个物体的原子或分子会发生怎样的变化呢?
水中有无数的水分子在杂乱无章地运动着。温度上升时,水分子会从水中飞出,在空气中飞来飞去,这便是水蒸气。另一方面,如果水冷却到了0℃,原本混乱地运动着的水分子就会有规律地排列成“晶体”,这就是冰。结晶的水分子无法自由地到处运动。即便这样,水分子也仍然在原地剧烈地振动。
温度越高,物体内部原子或分子的运动就越剧烈,而温度越低,物体中所含原子或分子的运动就越微弱。温度所反映的,就是物体中所含粒子运动的剧烈程度(动能)。
那么,“热”到底是什么呢?比如说,30℃与0℃的空气相比,前者更热。由于温度是粒子运动的剧烈程度,比起30℃的空气,0℃的空气中的粒子运动更迟缓。我们的身体处于空气中,不断地与气体分子相碰撞。因此,和0℃相比,在30℃的空气中,我们受到的气体分子的冲击更加强烈。事实上,热就是经由这些气体分子等微小粒子的碰撞所交换的能量。
虽说温度相同,50℃的洗澡水实在太烫,但50℃的桑拿却可以忍受。这是因为洗澡水中的水分子密度高,接触到皮肤并与之碰撞的水分子数就多。而气体中分子的密度比水中低很多,因而在空气中,与皮肤碰撞的分子相对较少。这样,从分子中接收到的能量也少,就不觉得热了。
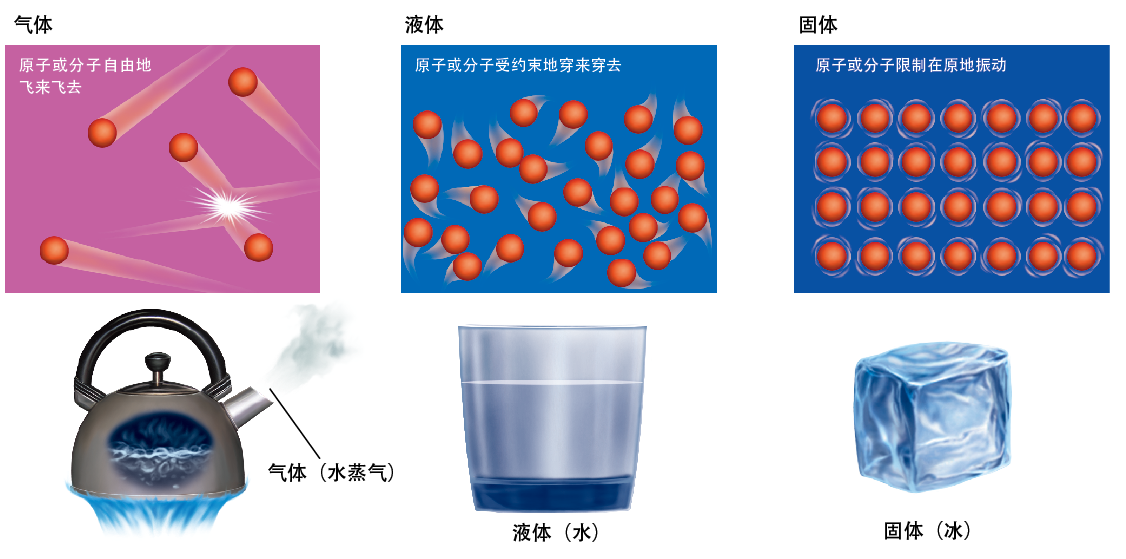
图1. 气体、液体和固体中,粒子的状态完全不同
随着温度降低,气体也逐渐收缩
空气受热上升,遇冷则下降。利用这个性质所发明的交通工具就是热气球。
空气变暖的话,其中所含的气体分子的运动就会变得剧烈,扩散范围也会增大。气体分子的数目不变而体积增加,因此变轻(密度变低)而上升。反过来如果空气变冷,气体分子的运动就变慢,从而被周围温暖的(剧烈运动的)分子挤压,集中在狭窄的范围内。最终,变重(密度升高)而下降。
就这样,随着温度的上升或下降,气体或膨胀或收缩。法国物理学家雅克·查理(1746~1823)在对氢气球的研究中发现,在气体压强一定的状态下,气体的体积和温度成正比。这就是“查理定律”(1787年)。
根据查理定律,气体(理想气体)温度每下降1℃,体积(以0℃时的体积为基准)便减少约273分之1。因此查理推测,如果气体温度持续下降,到-273℃时体积就会缩减成0,即达到温度的“下限”。于是这个温度被称为“绝对零度”。根据之后的研究,绝对零度被规定为-273.15℃。但实际上,由于构成物质的粒子本身有大小,绝对温度下物质的体积是不会变成0的。
不过,我们在表述温度的时候,使用较多的是以水变成冰的温度(0℃)以及水沸腾的温度(100℃)为基准的摄氏温度(℃)。但另一边,在科学的世界中常常使用以绝对零度为基准的绝对温度(K)。绝对温度即摄氏温度的数值加上273.15,因此0℃对应于约273K,100℃为约373K。另外,每1℃与每1K的间隔相同。
无数粒子相互碰撞所产生的“压强”
生活在地球上的我们持续受到大气压的影响。查理定律中的气体的体积与温度成正比,也仅仅在压强一定的情况下才成立。如果压强改变,气体的状态也将发生变化。
大气压强,一般以单位面积上“大气的重量”等方式来表现。地面上的物体受大气压影响却能够保持形状不变,是因为物体反过来施加了与大气压相当的压强。
气球能够保持形状,也是因为其内部的气体向外挤压的原因。气球内部向外推挤的压力,便来源于气球中的空气(气体分子)。气体分子在气球内部碰撞球壁,便会对气球施加微弱向外的力。虽然单个气体分子的碰撞所产生的力十分微小,无数气体分子接连不断的碰撞所产生的压强,却足以抵消掉大气压以及气球橡胶回缩所产生的压强,使内外压力达到平衡。
将容器内充入气体,并以盖子(忽略重量)密闭。盖子静止时,容器内封入气体的压强应和大气压相平衡。因此,若在盖子上加上砝码,容器中封闭气体的压强就会增加,内部气体对盖子增加的压力与砝码增加的压力相当。既然气体的压强是气体分子的碰撞所产生的,那么气体压强变化时,其体积与温度会产生怎样的变化呢?
当大气压与砝码所产生的压力合起来,正好是大气压产生的力的2倍时,内部气体的压强也该是大气压的2倍。若要让容器中气体的压强变成2倍,必须使“单个气体分子碰撞时对物体所施加的力的大小”也增为2倍,或是“气体分子碰撞的频率”增为2倍。
保持温度(气体分子的速度)或气体分子的数目一定,若要使气体分子碰撞的频率增为2倍,则容器体积需要减半。体积减半的话,气体分子的密度就变成2倍,气体分子对容器外壁的碰撞频率也就增为2倍。
最终,在气体的温度与气体分子数保持恒定的条件下,气体体积减半就会使压强增加2倍,反过来,气体体积若增为2倍则压强减半。也就是说,气体的体积与压强成反比。这个定律,就是英国物理学家罗伯特·玻意耳(1627~1691)发现的“玻意耳定律”(1662年)。
另外,保持体积一定,也有使气体压强增加的方法。提高气体的温度(气体分子的速度),气体分子碰撞时施加的力就会增加;增加容器中气体分子的数目,气体分子对内壁碰撞的频率也会增加。这些都会增加压强。
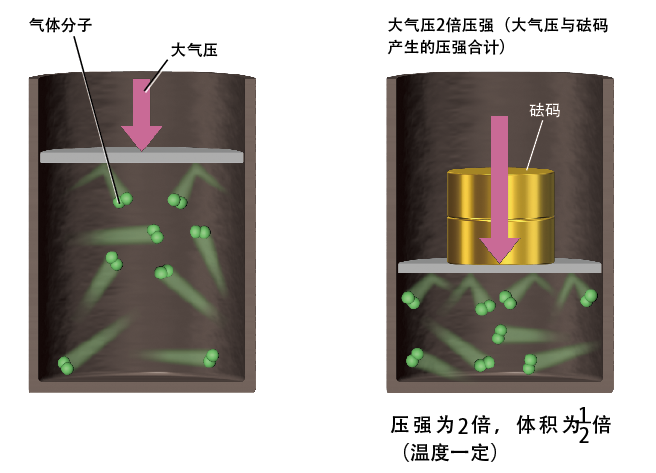
图2. 压强与体积成反比:“玻意耳定律”
对密闭容器内的气体所施加的压强增大时,气体体积缩小,气体产生的压力与外部施加的压力相平衡。气体压强是由于气体分子撞击所产生的。若气体的体积减半,气体分子对容器壁碰撞的频率就会变为原来的2倍,气体所产生的压强也升为2倍。当温度一定,气体与外部没有热交换,气体的体积与压强就成反比变化。
表现气体全部性质的“状态方程”
将表现体积与温度成正比的查理定律,和体积与压强成反比的玻意耳定律结合起来,就变成了“气体体积(V)与温度(T)成正比,与压强(P)成反比”。再进一步,若用n表示气体分子的数量,用R表示比例常数(称为气体常数),则可得到“PV=nRT”这样的关系式。这就是“理想气体状态方程”。在玻意耳与查理所进行的实验中,若气体分子总量相同,不论何种气体的体积与压强、温度的关系都相同。也就是说,体积、压强与温度中只要确定两者,余下的一个也就被确定。
状态方程对于任何遵从玻意耳定律和查理定律的气体都成立。然而,之所以强调“理想气体”,是因为实际气体中也有并不满足方程的情况。在极端低温以及高密度等情况下,受气体分子自身大小和分子间吸引力的影响,真实的气体状态会偏离状态方程。
推动工业革命的“热机”
提到“功”,会联想到什么呢?在物理学中,移动或搬运物体被称为做功。换句话说,使物体移动或变形而施加的能量就是功。随着气体的性质被人们所理解,对通过气体的膨胀或收缩而产生的功的研究也发展起来。
往轮胎内注入空气,轮胎的温度会稍微升高。这是由于注入空气使密度升高,压力与温度也上升了。我们会因接受原子和分子的动能而感到热,轮胎注入空气后温度上升,也是因为在注入空气时给出了能量(对空气做了功)。
随着热力学的发展,人们开发了把空气加热,使其膨胀(或收缩)对外做功的“热机”。在18世纪,利用蒸汽的“蒸汽机”逐渐风靡,推动了工业革命的兴起。蒸汽机也是一种热机。
在此,我们简单地介绍一下热机的原理。例如,通过将密闭容器中的活塞缓慢地推拉,来压缩或膨胀气体。气体会做功或被做功,这时气体的能量会发生变化。
首先考虑盛有气体的容器的体积缓慢减小,即“气体分子被活塞挤压”的情况。由于推压活塞对气体分子施加了力(做了功),气体分子的运动因此变得剧烈。也就是说,气体分子的动能增加,温度上升。
另一方面,容器体积缓慢膨胀,即“气体分子将活塞向外推”的情况下,气体分子与活塞碰撞,对活塞施加推力。气体分子损失的动能,正和它推活塞所做的功相当。也就是说,温度下降。
这样,气体自身所持有的能量和功之间发生了转换。为了方便思考,这个例子仅考虑了气体的能量和对气体所做的功,但实际上也会发生从外部加热以及向外部放热的情形。考虑到这些情况,气体能量的增加量(ΔU)、对气体所做的功(W)和外部对气体加的热(Q)之间,就有ΔU=W+Q的关系。这就是“热力学第一定律”。也被称为热力学中的“能量守恒定律”。
加热并输出功的“热机”
根据热力学第一定律,不加热而使气体做功(W为负)的话,气体的能量减小。因此,为了使气体能够连续做功,需要从外部持续地供应热。
“斯特林发动机”就是利用气体的膨胀和收缩,借由供热和放热的循环而持续运作的热机的例子。在实际中,斯特林发动机被用于船舶及潜艇。
(本文发表于《科学世界》2016年第10期)
请 登录 发表评论