当我们处于饥饿或能量缺乏的状态时,人体的细胞会做何反应?会有什么样的应对策略?我们细胞内的垃圾又是如何被清除的?清除过程要经历怎样的步骤?这是所有生物体都要面临和解决的问题,也同样吸引了许多科学家的关注。在这些问题的驱使下,科学家们竭尽所能力图破译这些复杂生命过程背后的奥秘。2016年诺贝尔生理学或医学奖就授予了从事这方面研究的日本东京工业大学的大隅良典(Yoshinori Ohsumi)教授,以表彰他为阐明自噬的基本分子机制方面做出的奠基性的工作。大隅良典教授的工作不但揭示了一种基本的细胞机能,更为许多疾病机制的阐明铺平了道路。

图1.大隅良典教授
什么是自噬?
上世纪50年代,比利时科学家克里斯蒂安·德迪韦(Christian de Duve)观察到细胞会包裹一些需要被降解的物质,形成一个称为自噬小体(autophagosome)的双层膜囊状结构,然后自噬小体会与溶酶体融合,进而降解这些成分。1963年的溶酶体国际会议上,德迪韦首次提出了自噬(autophagy)的概念,就此拉开了自噬研究的序幕。
自噬就是细胞内部出现了“自己吃自己”的情况。真核细胞由外层的细胞膜、中心的细胞核以及其间的细胞质构成。细胞内具有功能的细胞器都漂浮在细胞质里,这里每分每秒都发生着非常多的生理反应,供给生物体所需的能量,同时也伴随着废物的产生。细胞自噬就扮演着细胞内清道夫的角色,自噬小体收集细胞内受损的细胞器和其他垃圾,送给一种负责回收利用的“小隔间”——溶酶体,进而降解这些废物,并将代谢产物回收再利用。因此,自噬既是体内的“垃圾处理厂”,也是“废品回收站”。当细胞处于各种胁迫条件如饥饿时,自噬又能降解胞内一些不必要的物质,为细胞提供物质和能量,帮助细胞渡过艰难困境。
自噬在生物体内普遍存在,人体更不例外。自噬作用与我们的健康有着密切的联系。自噬活性缺乏会导致肿瘤、心血管疾病、阿尔茨海默病、帕金森病等的发生。如果我们能够知道如何控制自噬过程,就可以开启对人类重大疾病治疗的探索。
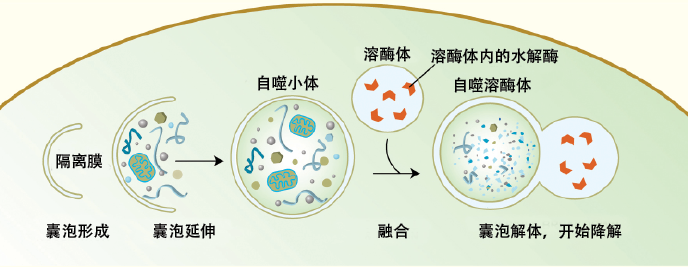
图2.自噬的基本过程 图/Alicia Meléndez & Beth Levine
大隅良典的奠基
虽然在1963年,人们就知道了自噬。但因为自噬过程非常复杂,也缺乏合理的技术方法,三十多年来,人们只能利用电子显微镜观察自噬的过程,对自噬的分子机制一无所知。1977年,大隅良典教授从美国回到母校东京大学,开始研究酵母液泡(一种类似溶酶体的细胞器)内蛋白质的降解过程。由于酵母细胞非常小,蛋白质的降解过程又非常迅速,在当时的显微镜技术下,很难清楚地观察到其内部结构的变化。因此,他并不能确定酵母细胞中也存在自噬现象。为了解决这一问题,他推测,如果能阻止自噬过程的最后一步—降解,那么酵母液泡中将会累积大量的自噬小体,就有可能在显微镜下观察到自噬现象。1992年,他培养了蛋白降解酶缺失的酵母突变株,并通过饥饿诱导自噬发生。他惊喜地发现,短短半个小时内,液泡内就聚集了未被降解的自噬小体,这也是人类首次在酵母中观察到自噬现象。大隅良典教授通过一系列精巧的实验,终于证明了自噬存在于酵母细胞中,更重要的是,这一发现为酵母成为研究细胞自噬的模式生物奠定了基础。
在上述实验结果的基础上,大隅良典教授推测,如果某一自噬关键基因突变了,那么就可能导致自噬过程无法正常进行,酵母突变株中被饥饿诱导的大量自噬小体的形成就有可能被抑制。为了得到更多的自噬相关基因,大隅良典教授开展了大规模的遗传筛选。通过对上千株酵母突变株的研究,找到了一批与自噬相关的突变体,并发现了15个参与自噬小体形成的基因,统称为Atg基因(autophagy related gene,自噬相关基因)。1997年,大隅良典教授小组克隆出了第一个酵母自噬基因,命名为Atg1。随后几年,陆续又有三十多个Atg基因被鉴定出来。进一步克隆和研究这些基因的功能,大隅良典教授发现它们“各司其职”,有的可以感知能量状态,有的诱导了自噬小体的形成,有的控制了自噬小体的大小,它们在自噬的不同阶段发挥了不同的作用。大隅良典教授的发现阐明了细胞如何循环利用自身物质这一基本过程,这为理解诸多生理现象,例如适应饥饿、免疫应答、衰老等打开了一扇窗户。
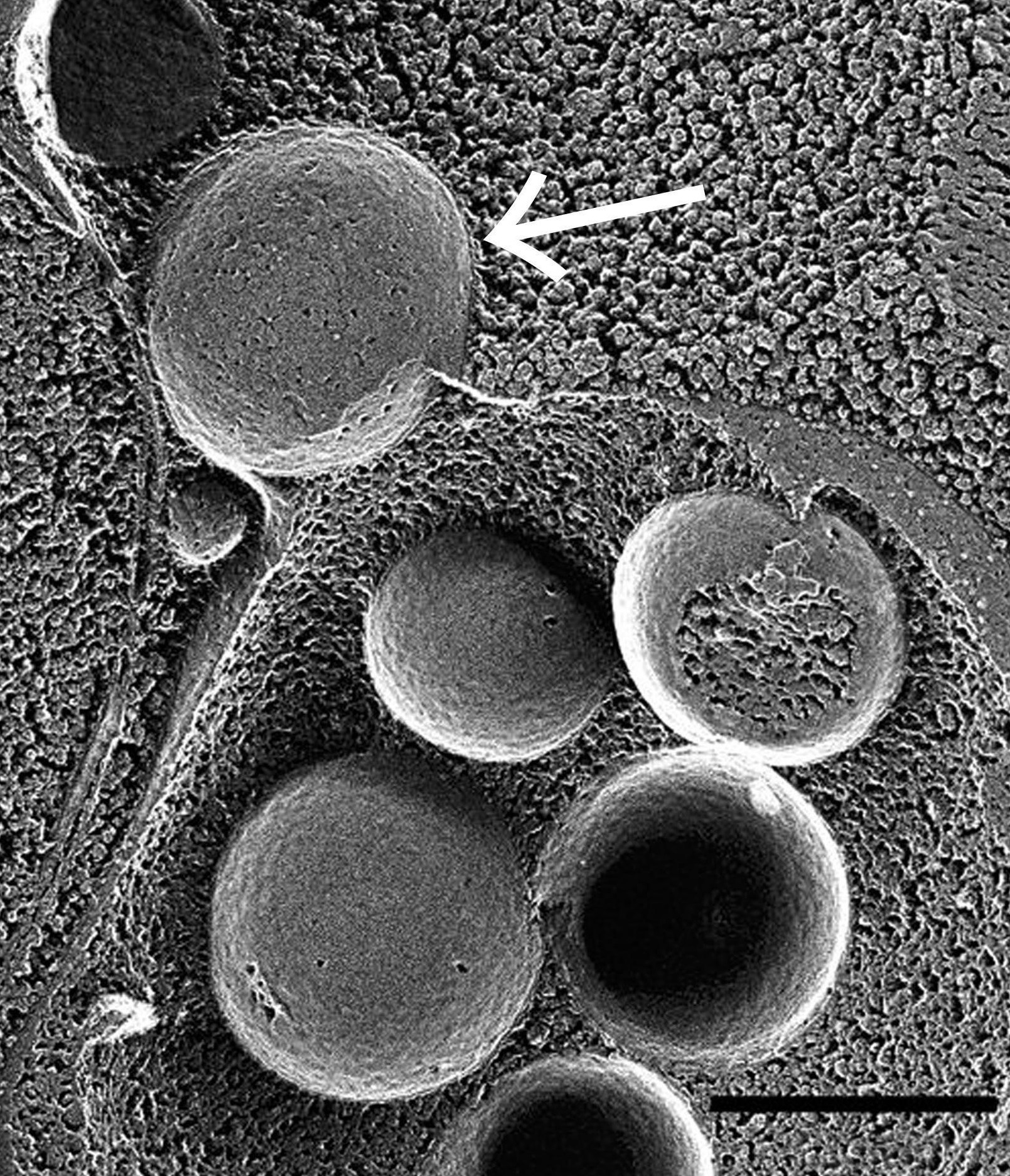
图3.这幅扫描电镜图像展现了在酵母细胞中,含有蛋白质的自噬小体(箭头所指)与含有酶的液泡结合的瞬间。 图/大隅良典
自噬领域的进展
当然,一个研究领域的建立并非是一位科学家单枪匹马的独立作战可以完成的,在自噬领域中还有许多优秀的科学家,也为自噬研究做出了卓越的贡献。丹尼尔·克利昂斯基(Daniel Klionsky)教授实验室研究了一种氨肽酶ApeI(Aminopeptidase I)是怎样运送到液泡内的,并找到一些相关基因,其中有些基因与大隅良典教授发现的相同。进一步研究还表明,ApeI是被一种类似自噬小体的膜结构包裹并运输到液泡中的。大隅良典的弟子水岛昇(Noboru Mizushima)教授还鉴定出了Atg12偶联的分子机制,以及Atg12在人类中的同源基因;他的另一位弟子吉森保(Tamotsu Yoshimori)教授则发现了酵母自噬的标志基因Atg8在哺乳动物体内的同源基因LC3,并建立了哺乳动物中自噬水平的经典鉴定方法。这些工作为人们在分子水平研究多细胞自噬过程开拓了新思路。此外,贝丝·莱文(Beth Levine)教授第一次将自噬与人类疾病联系在一起,她揭示了自噬基因beclin 1的缺失与人类乳腺癌等肿瘤的发生有关,使人们开始关注自噬异常在疾病发生发展中的作用,极大地推动了自噬领域的研究。
我国科学家也在自噬领域做出了应有的贡献,对推动自噬领域的发展起到了重要作用。多细胞生物的自噬通路比单细胞的酵母要复杂许多,有着很多酵母中不存在的步骤,也涉及到更多自噬基因的参与,人们对其知之甚少。张宏研究员建立了线虫这一研究多细胞生物自噬过程的模型,并通过遗传筛选得到了一系列多细胞生物特异的自噬基因,拓展了人们对多细胞生物自噬过程的认识。清华大学俞立教授实验室在自噬和溶酶体再生方面,陈烨光教授实验室在自噬和信号传导方面,中科院动物所陈佺研究员实验室在线粒体选择性自噬清除方面有着重要的贡献。此外,北京大学的朱卫国教授、中科院生化细胞所胡荣贵研究员、浙江大学刘伟教授等也都做出了杰出的工作。如今,我国几乎每年都在自噬领域有重大的科研成果展现出来,这也吸引了大量青年科学家加入该领域的研究。
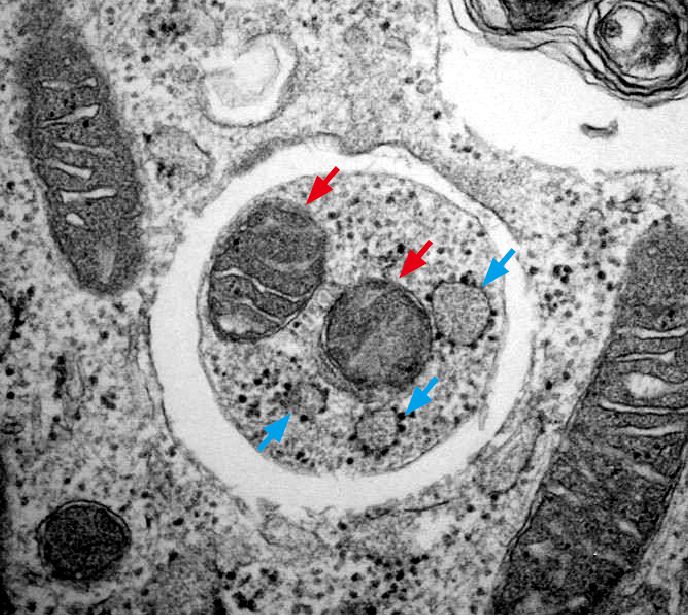
图4.饥饿胁迫下小鼠胚胎成纤维细胞的电子显微镜图像,可以看到在自噬小体内的线粒体(红色箭头)与内质网残片(蓝色箭头)。 图/水岛昇和Beth Levine
未来的自噬研究
大隅良典教授的成果奠定了自噬领域的基础,但自噬的故事才刚刚开始,人们对自噬的生理功能以及自噬与人类疾病的了解只是冰山一角。生物体拥有不同类型的细胞、组织和器官,还要经历发育、生长、衰老和死亡等不同阶段,而这些不同的状态需要感知的内外部信号及其自噬活性又各不相同。目前,对多细胞生物发育过程中自噬活性调控机制的研究还非常匮乏。
自噬异常会导致人体一系列疾病的发生,比如肿瘤的发生就与自噬有着密切的关系。自噬保证了细胞内正常的代谢和稳态平衡,生理条件下的基础自噬有效避免了细胞内受损蛋白质和细胞器的过度积累。从这个角度可以说,自噬是一种抑制肿瘤发生的机制。但随着自噬与肿瘤研究的逐步深入,科学家认识到,自噬对肿瘤的调节作用并非那么简单,而呈现出了一种复杂的双向调节。肿瘤细胞本身的代谢和增殖能力就远远高于正常细胞,其代谢所需的能量及生物合成的频率会相应提高。因此,自噬对肿瘤的发生也有促进作用。研究发现,自噬对不同类型的肿瘤、不同发展阶段的肿瘤以及所处不同外环境中的肿瘤具有不同的调节作用,它们之间的关系还有待更加深入的研究。
在神经退行性疾病的发生发展中,与自噬异常也脱不开干系。如帕金森病、阿尔茨海默病等,其发病大都是由有害的蛋白质在脑部的异常积累导致的。这些蛋白质积累到一定程度,就会对不可再生的神经元造成永久性损伤,很快地影响并阻碍神经信号和神经递质的正常传导,也会阻碍自噬的正常运转,甚至导致自噬系统“罢工”。如果我们能够在疾病发展之初就触发正常的自噬机制并清除这些有害的蛋白质,防患于未然,那么至今都无法医治的神经退行性疾病就有了治愈的希望。最近,人类遗传学疾病分析还发现,一些新的自噬基因的突变会引发人类神经退行性疾病。例如线虫中筛选出来的人类自噬同源基因EPG-6/WIPI4的突变会导致认知功能的缺陷,并引发一种叫做“伴随成人期神经退行性变性的儿童期静态脑病”(SENDA)的神经退行性疾病,这些研究表明了自噬通路和疾病之间具有直接关系,对以自噬为新靶点的药物研发具有前瞻性意义。
目前,自噬还处于基础研究阶段,它的分子机制和调控方法还等待我们去进一步的挖掘。大隅良典教授也在多次会议和谈话中,强调了基础科学对于转化医学的重要意义。另一方面,科学家的成长并非只在一朝一夕,大隅良典教授在研究自噬之前,曾在多个领域有过研究和贡献,有着数十年的科研积淀。在记者的采访中,大隅良典教授表示,比起他个人所获得的荣誉,他更关注这些荣誉给国家以及整个自噬领域所带来的荣誉,他希望能通过自己的影响促使日本政府、民间和媒体对自噬领域以及青年科学家的关注。如今,年逾七十的大隅良典教授仍保持着对新鲜事物的好奇和对科学的严谨和执着,希望他的科学理念可以给我们带来一些启示。
(本文发表于《科学世界》2016年第11期)
请 登录 发表评论