迷雾重重:围绕雌性生殖干细胞的争论
一石激起千层浪,哺乳动物雌性生殖干细胞的概念,从它在21世纪初被重新提出的那一天起,就一直是一个争论不休、分歧严重的话题。很多科学家列举出一系列新的科学证据,来否认哺乳动物雌性生殖干细胞的存在。其中,几个非常有趣的基因敲除小鼠模型,为哺乳动物雌性生殖干细胞的热浪泼了几盆最冷的冷水。在2004~2008年间,美国得克萨斯大学西南医学中心的迭戈·卡斯特里隆(Diego Castrillon)博士和瑞典于默奥(Umea)大学的华人科学家刘奎博士相继发现,在小鼠的卵母细胞(即已经分化的雌性生殖细胞)中敲除PI3K信号通路中的两个基因Foxo3a或Pten(PI3K信号通路是生物体内一个调节细胞增殖和存活的重要信号通路,与胚胎发育、新陈代谢、衰老和肿瘤发生都有密切关系),就会使卵巢中所有的卵母细胞从发育的沉睡状态苏醒过来,体积迅速增长到成熟卵母细胞的大小,但这些早熟的卵母细胞由于得不到卵巢内其他细胞的支持而最终走向死亡。这样一来,就造成了卵巢中“卵母细胞储存库”的迅速耗竭,使得这些小鼠在4个月龄的时候(大概相当于人的30岁左右)就丧失了生育能力。在人类临床上,把这种现象称为卵巢早衰,在现代人群中的发病率大概在1%~2%之间。卵巢早衰造成无法逆转的女性不育,而且它会带来一系列内分泌紊乱的症状,比如骨质疏松、皮肤粗糙、生殖系统癌症发病几率增加等,因此被称做“女人青春的天敌”。但是试想一下,如果在Foxo3a或Pten敲除的小鼠体内,或者卵巢早衰的患者体内,具有上文中隆重介绍的雌性生殖干细胞,卵巢中的卵母细胞怎么会耗竭呢?即使分化的卵母细胞由于病理原因被大量消耗,理论上具有自我更新和分化能力的生殖干细胞也应该源源不断地产生出新的卵母细胞来。为什么我们没有看到这种“野火烧不尽,春风吹又生”的结果呢?
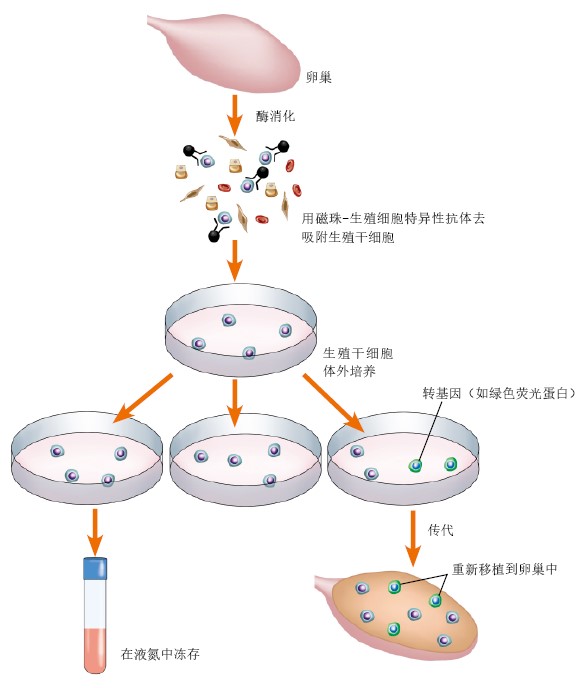
雌性生殖干细胞的拥护者辩解道,在上述基因敲除小鼠模型或卵巢早衰患者体内,病理性因素不仅造成了已分化的卵母细胞大量死亡,也有可能对生殖干细胞本身或其所处的微环境产生不良影响,使得生殖干细胞与卵母细胞玉石俱焚、同归于尽。这种解释虽然在逻辑上言之有理,但还没有得到实验证据的支持。
除了旗帜鲜明地认为雌性生殖干细胞“有”或“无”的两派以外,还存在着第三种声音:一些科学家认为,在成年哺乳动物的卵巢中,可能确实还遗留着一些雌性生殖干细胞,它们能够在特定条件(比如合适的体外培养环境)下分化成卵母细胞;但是,在动物体内的正常生理情况下,这些干细胞是不发挥功能的,不能补充和重建卵巢中的卵母细胞储存库。这种“中庸观念”虽然目前只被少数科学家所倡导,但却最大程度地解释了目前已有的实验结果,最大程度地弥合了“有”、“无”两派的分歧。争论是好事,因为它说明人们对这一话题的兴趣与关注。分歧可以在未来被弥合,因为争论的双方都使用同一种语言:以实验科学为惟一论据,个人观点必需被确凿的实验结果所修正。真理在争论中逐渐显露它的真容。分歧被弥合的那一天的到来,就意味着人类对哺乳动物生殖过程有了更深刻的认识。
余音绕梁:雌性生殖干细胞研究的未来
哺乳动物雌性生殖干细胞的横空出世,不仅引发科学界热烈讨论这个引人入胜的科学理论问题,人们也立即意识到了它背后隐藏的巨大应用价值。并且,它的出现,有可能和试管婴儿、体细胞克隆等技术一样,对人类已有的社会观念和社会秩序造成巨大冲击。目前,雌性生殖干细胞“犹抱琵琶半遮面”,尚未能用于卵巢早衰的临床治疗。难道人们就只能坐视卵巢早衰患者走上不育的不归路吗?先前关于Foxo3a和Pten基因敲除小鼠的研究发现,这两种基因使卵母细胞的进一步发育处于停滞状态,从而维持卵巢中的卵母细胞储存库。斯坦福大学华人科学家薛仁望博士和李晶博士,利用几种能抑制Foxo3a和Pten功能的小分子化合物,唤醒卵巢中沉睡的卵母细胞,并成功地利用此方法得到成熟的卵母细胞,产生出了健康的子代小鼠。这项技术,使我们得以人为地激活衰老卵巢中残存的卵母细胞,为患者解决不育难题。但是,它的一个重要前提是,卵巢中必须还有残余的卵母细胞,否则这最后的希望仍将破灭。只有雌性生殖干细胞,才能使人类辅助生殖技术完全摆脱对卵巢原有卵母细胞的依赖。但到目前为止,还没有用雌性生殖干细胞恢复女性生育能力的成功尝试。
红颜易老,佳期难再,女性的生殖潜能随着青春一道,悄悄流逝,只能是“无可奈何花落去”。但是,曲径通幽,峰回路转,雌性生殖干细胞的发现与利用,有可能给人带来“似曾相识燕归来”的惊喜。笔者乐观地认为,在未来十年,当现在这一代花季少女步入婚育年龄的时候,这个引人入胜的科学故事将至少演绎出阶段性的结论,而在科学的春天里成长起来的当代中国生殖生物学家,将为这部传世之作谱写重要篇章。
(本文发表于《科学世界》2013年第11期)
请 登录 发表评论