大肠杆菌(Escherichia coli)是人和动物肠道中最主要、数量最多的一种细菌,因为它们最喜欢在大肠内扎堆,所以得了个大肠杆菌的名号。大肠杆菌的拉丁属名Escherichia来源于其发现者西奥多·埃希(Theodor Escherich)。
作为肠杆菌科的一名成员,大肠杆菌是一种两端钝圆、能运动、无芽孢的革兰氏阴性短杆菌。除某些菌型能引起腹泻外,大肠杆菌一般不致病,并且还能在肠道内合成维生素B和K,对人体有益。对我们来说,这种小生物既亲近又陌生。在我们出生后几小时内它们就在我们的肠道定居了;平常,它们不惹是生非的时候,我们还真想不起来身上住着这么个房客。中国科学院微生物研究所的陶勇研究员多年从事大肠杆菌研究工作,他对这种生物有着自己的看法。

图1. 2011年5月中旬,德国发生了出血性大肠杆菌疫情。在短短的几天时间内,疫情已经扩散到欧洲全境,随之而来的是生菜、豆芽的滞销,以及人们对食品安全的恐慌。更让人不能释怀的是,此次疫情的源头一直未被明确。于是有人猜测,引起疫情的病菌是从实验室逃脱的。其实,具有致病性的主要是O系列菌株,而且它们也不是从实验室逃逸出去的。
沉默的房客
一个人每天平均从粪便中排出1011〜1013个大肠杆菌。它同各种粪便细菌和类似的生活在土壤或植物降解物中的细菌(最常见的是产气肠杆菌,学名Enterobacter aerogenes)一起被归为“大肠菌群”。因为大肠杆菌在粪便中数量极多,所以也经常作为检查水源是否被粪便污染的标志,其测量标准就是大肠菌群指数。不过,利用大肠杆菌作为粪便污染的指示物也可能产生误导性的结论,因为在其他环境如造纸厂中,大肠杆菌也可大量存在。
在大多数情况下,大肠杆菌都是安分守己的,它们只在大肠这一亩三分地上活动。所以,在大肠杆菌被发现后的很长一段时间里,人们都认为它们是对人体无害的共生菌。不过,这不是说它们就不会给我们找麻烦。
当细菌离开肠道进入泌尿道可以导致感染,由于性接触会导致细菌进入膀胱,有时被称作“蜜月膀胱炎”。当细菌由于溃疡导致的穿孔进入腹腔,通常会导致致命性的腹膜炎感染。还好,大肠杆菌对一些抗生素,如链霉素非常敏感,一般情况抗生素能够有效治疗。
还有一些狠角色。大肠杆菌的某些菌株具有内毒性(其中一些类似导致痢疾的毒素),可以导致食物中毒,这通常是因为使用了被污染的肉类(通常是屠宰过程或储藏贩卖过程中的污染所致,加上食物未完全煮熟无法杀死细菌)。疾病的严重程度可以相差很多,尤其对儿童、老人和免疫缺失病人可以是致命的,但通常是温和的。
大肠杆菌不同部位有着不同物质都会引起人体的免疫反应,O抗原存在于细胞壁上,它是细胞壁脂多糖最外层的特异性多糖,由重复的多糖单位所组成。K抗原是位于O抗原外层的多糖,与细菌的侵袭力有关。H抗原位于鞭毛上,这是大肠杆菌区别于其他肠道细菌的特异性抗原。目前就是根据3类抗原种类的不同,给大肠杆菌划分家谱的。所以此次大肠杆菌事件中的O104:H4就是根据O抗原和H抗原进行命名的,这并不是什么实验室培育出的新型大肠杆菌的编号。
从1997年第一个大肠杆菌全基因组被测序以来,已经有超过60种大肠杆菌全基因组序列的秘密被解开。目前已经进行研究的这些大肠杆菌只有20%的基因组序列是共同拥有的。那是不是说明它们根本就不是一种细菌?
“确实有学者提议将大肠杆菌划分成不同的种属,不过,这些种类在形态上的差别很小,并且行为也近似,所以,目前在分类上仍旧将这些大肠杆菌作为一个种来处理,”陶勇研究员介绍说。
到目前为止,人们发现的致病性较强的菌株都是O系列的。而在实验室应用的大肠杆菌,其实是O抗原丢失的菌株,简单来说就是失去了所有的致病因子(荚膜等)。这些实验室用菌株分为B系列和K系列。两者的区别仅在于分别适用于药品研制方面和食品开发方面。而共同点是,在自然条件下生活能力有限,即使从实验室跑出去,也无法在环境中立足。陶勇研究员介绍说:“在20世纪70年代,利用大肠杆菌进行分子生物学实验之初,美国每年都进行听证会,评估其危险性。如今,这种评估已经是形式大于实质的活动了。因为从70年代至今,没有一个病例是因为实验室大肠杆菌菌株引起的。”
摆上实验台
大肠杆菌第一次进入实验室,是以噬菌体宿主的身份出现的,正是大肠杆菌材料的出现,对噬菌体的研究才取得了迅速发展。以德尔布吕克(M. Delbruck)和赫尔希(A.D.Hershey)等领导的“噬菌体小组”围绕噬菌体与感染细菌细胞的相互关系进行了大量深入的研究。随着一个个大肠杆菌被噬菌体撕碎,研究成果喷涌而出:1940年德尔布吕克阐明了噬菌体的复制周期;1950年尔沃夫(A.Lwoff)揭示了溶原性噬菌体诱导的原理;1952年赫尔希证明了噬菌体DNA的感染性;1952年津德尔(N.D.Zinder)发现了噬菌体的转导现象;1952年沃尔曼(E.Wollman)发现了溶原性噬菌体。
1973年初,美国斯坦福大学的科恩(Stanley Cohen)和旧金山大学的博耶(Herbert Boyer)合作完成了基因技术的第一次实验,实验使用的材料正是大肠杆菌。研究人员找到了适合裁剪和黏贴基因的关键的两种酶—限制性内切酶和连接酶,将抗四环素的基因成功转入到大肠杆菌中去,并使其获得了抗四环素的性状。这项实验为后来分子生物学和生物技术的蓬勃发展打开了大门。
在陶勇研究员看来,大肠杆菌已经是现代分子生物学实验室和生物技术实验室不可或缺的重要生物。首先,大肠杆菌的遗传背景相当简单,大肠杆菌的DNA包含有460万个碱基,而模式植物拟南芥的DNA的碱基数量达1.25亿。目前,对于大肠杆菌基因组已经了解得非常清楚,可以有目的地进行遗传操作。其次,利用大肠杆菌进行转基因操作的效率非常高,利用1微克的目标DNA(来源于其他生物的DNA)就可以转化数量为1010的大肠杆菌细胞,这就保证了实验操作有充足的材料。同时,在大肠杆菌中,我们能顺利完成目标DNA的复制,以及转基因载体—质粒的构建。这就相当于在大肠杆菌中可以任意调整基因的生产流水线,我们可以比较轻松地安排新员工(基因)进去工作,从而拼合出我们想要的、有特殊功能的DNA序列。
当然,大肠杆菌的功能还不止拼接DNA这么简单。在流水线拼好之后,它还能让其运转起来,生产出相应的蛋白质等产物。目前发现的很多新基因,我们想知道它们具体有什么作用,就把它们放到大肠杆菌里去,这样就能知道新基因的功能了。比如,合成胡萝卜素的基因导入到大肠杆菌中去,就能变成产胡萝卜素的橙红色大肠杆菌,也就验证了这些关键基因的作用。
由于大肠杆菌有良好的可操作性和高繁殖速度的特性,使得它成为验证遗传学和分子生物学假说的良好载体。比如,抗癌药物紫杉醇(Taxol)前体合成就可以在大肠杆菌中完成。“当然,这些产物可能会影响大肠杆菌的生长,如果能够验证设计好的路径是可行的,我们可以将这条生产线搬到其他宿主菌(比如酵母)里面去,以提升生产效率。而大肠杆菌的意义就在于能提供一个便捷迅速的实验平台,”陶勇研究员解释说。
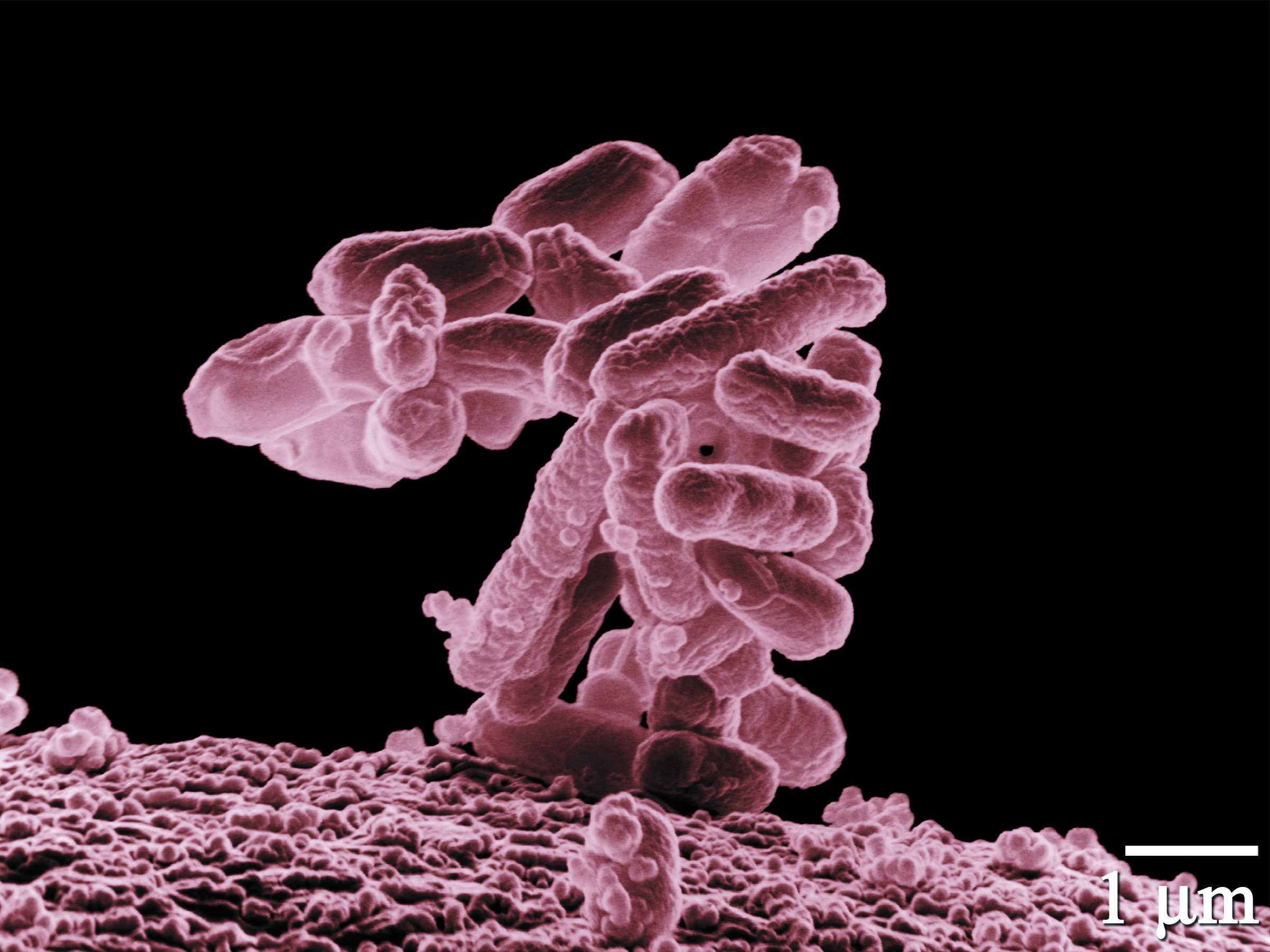
图2. 大肠杆菌并非都是我们的敌人,实验室的大肠杆菌都是筛选出来的没有致病性的菌株。
(本文发表于《科学世界》2011年第8期)
请 登录 发表评论