2012年,日本京都大学教授山中伸弥凭借在干细胞领域的突破性研究,摘得了诺贝尔生理学或医学奖的桂冠。几个月后,日本首相安倍晋三承诺将在未来10年里投资1100亿日元(约10亿美元),将日本打造成再生医学(regenerative medicine)的全球领袖。
 ▲山中伸弥教授是2012年的诺奖得主之一(图片来源:诺奖官网截图)
▲山中伸弥教授是2012年的诺奖得主之一(图片来源:诺奖官网截图)
由上而下的推动中,日本在2014年出台了两项法案,为再生医学疗法的上市提供了快车道,这也让大量基于干细胞的疗法搭上了便车。5年过去了,这些疗法真的改变了患者们的生活吗?《自然》近期的一篇长文对此进行了总结与反思。
本文的作者David Cyranoski先生指出,干细胞疗法的兴起,是一个全球普遍的现象。然而无论是发达国家,还是发展中国家,许多监管部门从未停止对这些疗法进行有效管理的努力。举例来说,今年6月,美国的“干细胞诊所”迎来当头一棒:FDA宣布将取缔那些滥用患者信任,但安全性和疗效都没有得到验证,有时甚至会危害患者的疗法。

▲这篇长文对一些做法提出了质疑(图片来源:参考资料[1])
《再生医学安全性法案》(Act on the Safety of Regenerative Medicine)中规定,医院和诊所想要开展细胞疗法,不需要进行通常意义上验证其有效性的临床试验。相反,它们只需要提供证明,表明其生产设施具有日本厚生劳动省的资质,并通过独立委员会的检测即可。
从某方面看,这一做法消除了“非法诊所”的存在:一切能够提供细胞疗法的医院和诊所,都在监管部门得到了注册。但一些专家指出,这个法案很容易带来误导。 一家医疗机构得到认证,并不代表它提供的疗法也得到了认证。
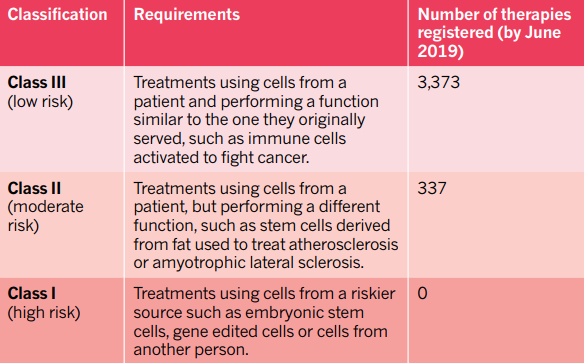
▲完成注册,但未经验证的疗法一览(图片来源:参考资料[1])
很多患者并不理解两者之间的区别。 《自然》的数据指出,截止到2019年6月,注册具有“低风险”(使用患者体内分离出的细胞,让它们行使类似的功能。比如分离免疫细胞抗击癌症)的细胞疗法数量高达3373项,“中风险”(使用患者体内分离的细胞,行使不同的功能。比如分离脂肪干细胞,治疗各种疾病)的疗法为337项。每年,大量患者正在接受这些“疗法”的治疗。
另一项《药物与医疗器械法案》(Pharmaceutical and Medical Devices Act)的应用范围更广。如果一款细胞疗法能在小型临床试验中提供关于疗效的证据,那么它将可以得到“有条件批准”,在全日本范围内进行治疗,且保险系统会支付治疗的开支。这和上述限于特定医院或诊所的疗法相比,意义有着天壤之别。
迄今,已经有三款疗法得到了“有条件批准”。由于考虑到了疗效,这种做法看似更为靠谱。但也有一些专家指出,相应的临床试验规模太小,不具有可靠性。

▲得到了“有条件批准”的三款疗法(图片来源:参考资料[1])
《自然》报道中提到,在这三款得到“有条件批准”的疗法中,一种叫做HeartSheet的疗法从肌肉中分离出细胞,进行一系列处理,来帮助修复受损的心肌。让其得到批准的临床试验,仅有7名患者参与。而且,这项研究没有设置对照。
这项技术的共同发明人之一说,患者群体的症状会不断恶化,而在这7名接受治疗的患者中,有5名的病情没有变得更糟糕,因此足以表明其有效性。有趣的是,在另一项有约3500人参与的大型临床试验中,科学家们发现大部分具有类似病情的心脏病患者,并不需要严重干预,就可以做到病情稳定,甚至慢慢变好。面对本文作者的提问,这名共同发明人没有做出回应。而2016年的一篇Cell Stem Cell论文指出,它未经充分验证(undertested),且开价过高(overpriced)。
《自然》报道的作者指出,这5年来的宽松监管虽然促进了整个产业的发展,但患者为之付出了代价。
拿仅仅完成注册,尚未得到验证的疗法来说,作者介绍了这样一个案例:在一家细胞疗法诊所,从业人员从患者体内分离出脂肪干细胞,并将它们注射入血液中,以求延缓“渐冻人症”的病情。作者透露,至少有10名患者接受了这一疗法的治疗,每次治疗需要150万日元,约1.4万美元。 这样的治疗,每2-3个月就要进行一次。
该诊所的客服人员介绍说,有50%-70%的患者在治疗后,症状得到了缓解。而作者接触到的5名专门研究这种疾病的科学家说,没有理由相信这种干细胞疗法能起到任何效果。
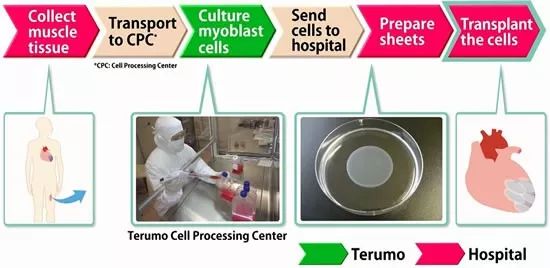
▲HeartSheet的作用示意图(图片来源:参考资料[3])
而对于得到“有条件批准”的HeartSheet,作者则介绍了另一个病例:一名患有扩张型心肌病的男子在看到电视广告后,知道了这种疗法的存在。尽管这种治疗需要做开胸手术,风险巨大,但他还是决定做了手术。术后,他从未感到症状有所缓解。9个月后,他第一次出现了气短的现象,并确诊出现了心衰。又过了没几个月,医生说他的病情出现恶化,需要准备接受心脏移植。
由于这只是一个个例,我们还不能确定就是HeartSheet手术导致了患者的病情恶化。 但这种不确定性,依旧给这种疗法的可靠性打上了一个大大的问 号 ,尤其当你考虑到这项试验只有7名患者参加的时候。
尽管有着这些治疗案例,作者依旧在文章中指出,并不是所有人都反对日本的这种做法。甚至有些人拿着日本的细胞疗法产业为例,给美国FDA施压,质问为何不能像日本一样批准更多疗法上市。FDA生物制剂评估与研究中心主任Peter Marks博士无奈地回应说,FDA的宗旨是确保这些疗法安全且有效。
斩获诺奖,引起日本细胞疗法热的山中伸弥教授,则保持了一贯的低调。尽管正在开发基于干细胞的疗法,但他并不急着把疗法推向临床。“只要有条件,我们就应该考虑双盲对照,”他在《自然》的采访中说到:“科学家们应该尽全力保证临床试验的客观性和安全性。”
参考资料:
[1] The potent effects of Japan’s stem-cell policies, Retrieved September 25, 2019, from https://www.nature.com/articles/d41586-019-02847-3
[2] Federal court issues decision holding that US Stem Cell clinics and owner adulterated and misbranded stem cell products in violation of the law, Retrieved June 4, 2019, from https://www.fda.gov/news-events/press-announcements/federal-court-issues-decision-holding-us-stem-cell-clinics-and-owner-adulterated-and-misbranded-stem
[3] Terumo Launches HeartSheet®: A Global First Cellular and Tissue-based Product Designed for the Treatment of Heart Failure, Retrieved June 6, 2016, from https://www.terumo.com/pressrelease/detail/20160606/299/index.html
[4] Christopher McCabe and Douglas Sipp, (2016), Undertested and Overpriced: Japan Issues First Conditional Approval of Stem Cell Product, Cell Stem Cell, DOI: http://dx.doi.org/10.1016/j.stem.2016.03.006
更多精彩内容,请关注“学术经纬”(Global_Academia)

本文经“学术经纬”授权转载。文章内容不代表领研网立场,如须转载请联系原作者。

